TABLE DES MATIERES
PREMIERE PARTIE : LA PAROI ABDOMINALE............................................................................................................. 1
CHAPITRE I : LES TRAUMATISMES DE LA PAROI ABDOMINALE ET
DU DIAPHRAGME................................. 2
I.
Les traumatismes de la paroi abdominale............................................................................................................ 2
II.
Rupture du diaphragme......................................................................................................................................... 2
III.
Relaxation diaphragmatique................................................................................................................................ 3
CHAPITRE II : LES TUMEURS DE LA PAROI ABDOMINALE........................................................................................ 4
I.
Tumeurs bénignes................................................................................................................................................... 4
II .
Tumeurs malignes................................................................................................................................................. 4
CHAPITRE III : LES DEFECTS DE LA PAROI ABDOMINALE......................................................................................... 5
I. Classification et description.................................................................................................................................. 5
II.
Etiologie................................................................................................................................................................... 8
III.
Manifestations cliniques et pronostic............................................................................................................... 8
IV.
Traitement............................................................................................................................................................ 13
DEUXIEME
PARTIE : L’ŒSOPHAGE................................................................................................................................ 16
CHAPITRE
I : GENERALITES................................................................................................................................................ 17
I. Manifestations
cliniques...................................................................................................................................... 17
II.
Méthodes d’exploration...................................................................................................................................... 21
CHAPITRE II : PATHOLOGIE................................................................................................................................................ 25
I.
Maladies affectant la motricité oesophagienne................................................................................................ 25
II.
Les oesophagites................................................................................................................................................. 30
III.
Les tumeurs......................................................................................................................................................... 39
IV.
Les traumatismes................................................................................................................................................ 44
V.
Divers..................................................................................................................................................................... 45
TROISIEME
PARTIE : L’ESTOMAC ET LE DUODENUM............................................................................................. 48
CHAPITRE
I : GENERALITES................................................................................................................................................ 49
I. Manifestations
cliniques...................................................................................................................................... 49
II.
Méthodes d’exploration...................................................................................................................................... 49
CHAPITRE II : LES GASTRITES........................................................................................................................................... 52
I.
Les gastrites aiguës.............................................................................................................................................. 52
II.
Les gastrites chroniques..................................................................................................................................... 53
CHAPITRE III : L’ULCERE GASTRO-DUODENAL........................................................................................................... 58
I.
Epidémiologie......................................................................................................................................................... 58
II.
Etiologie et physiopathologie............................................................................................................................ 58
III.
Manifestations cliniques................................................................................................................................... 60
IV.
Diagnostic............................................................................................................................................................ 60
V.
Complications....................................................................................................................................................... 61
VI.
Traitement de l’ulcère gastro-duodénal.......................................................................................................... 63
VII.
Les interventions chirurgicales dans l’ulcère gastro-duodénal................................................................. 67
CHAPITRE IV : LES TUMEURS GASTRIQUES
CHAPITRE V: LA DYSEPSIE
CHAPITRE VI: L'OBESITE MORBIDE
LES
TRAUMATISMES DE LA PAROI ABDOMINALE
ET DU
DIAPHRAGME
I. LES TRAUMATISMES DE LA PAROI ABDOMINALE
Les traumatismes fermés ou ouverts de la paroi
abdominale posent en général la question des lésions intra-péritonéales
associées. Celles-ci déterminent la gravité du traumatisme. Elles entraînent
soit des hémorragies, rupture ou plaie d’un organe plein, soit des péritonites.
Les plaies abdominales seront donc explorées
soigneusement. Si la lésion atteint le péritoine, une laparotomie exploratrice
sera en général indiquée. En outre, s’il s’agit d’une arme, la laparotomie ou
la cœlioscopie sont obligatoires.
Dans les traumatismes fermés de l’abdomen, une
surveillance étroite (en soins intensifs) du malade s’impose. Une exploration
chirurgicale est indiquée en cas de suspicion d’hémorragie importante ou
persistante ou de signes d’irritation péritonéale. Parmi les examens
complémentaires étant éventuellement indiqués, signalons : la biologie
« usuelle », la recherche de sang dans les urines, l’abdomen à blanc
sans préparation, l’échographie et la tomodensitométrie. Plus rarement on
utilisera l’urographie et l’artériographie.
Le traitement dépend de l’organe atteint et de la
nature des lésions.
|
Fréquence des lésions viscérales en cas de traumatisme fermé de l’abdomen chez l’adulte |
|
|
Viscère atteint |
Fréquence, % |
|
Rate Reins Intestin Foie Hématome rétro-péritonéal Mésentère Pancréas Diaphragme |
25 24 16 16 3 3 1 1 |
Une rupture spontanée des muscles de la paroi
abdominale (le plus souvent la partie sous-ombilicale des grands droits)
survient parfois au cours d’efforts minimes tels un effort de toux.
II. RUPTURE DU DIAPHRAGME
La rupture traumatique du diaphragme survient en
général lors d’une hyperpression abdominale causée lors d’une chute d’un
immeuble, soit lors d’un accident de roulage à l’intérieur d’un véhicule.
L’hyperpression abdominale conduit à une déchirure
diaphragmatique le plus souvent dans la partie membraneuse. Il s’ensuit un
engagement des viscères abdominaux dans la cavité thoracique. La rupture
concerne le plus souvent la coupole diaphragmatique gauche et les viscères
incarcérés sont le plus souvent la rate, le côlon gauche ou l’estomac. La
rupture diaphragmatique peut être parfois relativement asymptomatique et le
diagnostic est alors tardif après quelques jours. Dès le diagnostic, la plaie
est abordée par une incision sous-costale gauche et le traitement consiste en
la réduction des viscères et à la suture du diaphragme. Un drainage pleural
associé est en général réalisé. Le pronostic est bon.
III. RELAXATION DIAPHRAGMATIQUE
Une lésion traumatique peut induire la dénervation
d’une coupole diaphragmatique. Le diagnostic en général tardif repose sur un
cliché de thorax. La relaxation diaphragmatique est en principe non traitée.
Dans des cas très particuliers, une plicature chirurgicale est proposée.
Le diagnostic se fait parfois plusieurs mois ou
années plus tard lors d’une radiographie de thorax de routine.
LES TUMEURS DE
LA PAROI ABDOMINALE
I. TUMEURS BENIGNES
Toutes les tumeurs cutanées et conjonctives peuvent
se rencontrer au niveau de la paroi abdominale. Les plus fréquentes sont les
lipomes (20%). Leur diagnostic et leur traitement sont les mêmes que pour les
autres localisations de ces tumeurs.
II. TUMEURS MALIGNES
1. Primitives
Les sarcomes (rhabdomyosarcomes, liposarcomes, ...)
sont plus fréquents que les carcinomes d’origine cutanée. Ils naissent des
couches profondes de la paroi et métastasient essentiellement par voie
sanguine. La résection en bloc de toute la paroi abdominale et éventuellement
de la zone de drainage ganglionnaire, est indiquée. Le pronostic est très
réservé.
2. Secondaires
Les métastases des adénocarcinomes originaires de la
sphère abdominale se font plus souvent au niveau de la paroi abdominale que
dans les autres tissus mous. Les localisations dans la région ombilicale sont
les plus fréquentes. La présence de telles métastases indique la généralisation
de la tumeur maligne et est donc de très mauvais pronostic. Un traitement
chirurgical est rarement indiqué.
3. Les tumeurs desmoïdes
Les tumeurs desmoïdes entrent dans le groupe des
fibromatoses. Elles sont constituées par des faisceaux enchevêtrés de collagène
mûr, contenant une quantité variable de fibroblastes exempts d’atypie
nucléaire. Elles sont habituellement mieux différenciées en leur centre qu’à
leur périphérie qui est plus cellulaire. Les mitoses sont peu fréquentes. Bien
que paraissant bien limitées, elles infiltrent les structures voisines.
Il faut distinguer deux types de tumeurs desmoïdes
abdominales de structure identique, mais de comportement différent. Les
premières, les plus fréquentes, se développent dans la région péri-ombilicale à
partir de l’aponévrose du muscle grand droit. Elles se rencontrent chez la
femme dans le post-partum ou dans les deux sexes après une chirurgie ou un
traumatisme abdominal. L’existence d’une polypose familiale favorise leur
développement. Elles se présentent comme des masses dures non mobilisables par
rapport à la paroi mais mobilisables par rapport à la peau. Elles sont curables
à condition que l’exérèse soit large. Une exérèse trop limitée entraîne un
risque de récidive locale. Les secondes sont profondes et naissent au départ du
mésentère. Elles se rencontrent presque exclusivement chez des patients
porteurs d’une polypose familiale. Leur développement suit pratiquement
toujours une intervention chirurgicale (colectomie par exemple). Bien qu’elles
gardent une allure histologiquement bénigne, elles ont un comportement
nettement plus agressif et peuvent entraîner une obstruction intestinale ou des
fistules. Elles récidivent fréquemment après exérèse.
LES DEFECTS DE
LA PAROI ABDOMINALE
I. CLASSIFICATION ET DESCRIPTION
Il existe deux catégories de défects sur la base de
leur origine :
Les défects congénitaux
qui peuvent résulter de l’un des trois défauts suivants :
1.
une
agénésie de la paroi abdominale ou du diaphragme (ex. gastroschisis ou
extrophie vésicale) ;
2.
un
orifice abdominal à localisation normale mais élargi (ex. : hernie ombilicale
du nouveau-né) ;
3.
un
orifice normalement constitué à la naissance, mais dont les parois sont trop
faibles et se laissent progressivement élargir au cours de la vie (ex. : hernie
ombilicale de l’adulte, hernie inguinale directe ou oblique externe).
Les défects acquis
:
faiblesse
musculaire, éventrations...
Les éventrations
apparaissent après une intervention chirurgicale. Elles se produisent donc à
travers un orifice anormal créé
durant la vie. Le terme « éviscération »
est réservé aux éventrations se produisant dans la période postopératoire
précoce (durant les quinze premiers jours) et s’accompagne de l’extériorisation
du contenu de la cavité abdominale.
A. REGION
INFERIEURE DE LA PAROI ABDOMINALE ANTERIEURE
Près de 80% des hernies apparaissant chez l’adulte
sont situées dans les régions inguino-crurales. De très nombreuses variétés
existent : nous ne décrirons que les plus fréquentes.
1. Hernie inguinale indirecte externe
La hernie indirecte externe se développe à travers
l’orifice profond du canal inguinal, au niveau de la fossette inguinale
externe, c’est-à-dire en dehors de l’artère épigastrique. Elle suit le canal
inguinal (avec le cordon spermatique chez l’homme) et se développe vers le
scrotum ou la grande lèvre. Le sac herniaire est dans le cordon spermatique
(intra-funiculaire). Cette hernie est due à la persistance d’un résidu du canal
péritonéal vaginal chez l’enfant. L’orifice et le sac herniaire s’élargissent
progressivement sous l’influence de la pression intra-abdominale. Présente à la
naissance, cette lésion se manifeste soit durant l’enfance, l’adolescence, soit
entre 20 et 30 ans. Elle est souvent bilatérale (35%), particulièrement si elle
affecte le côté gauche.
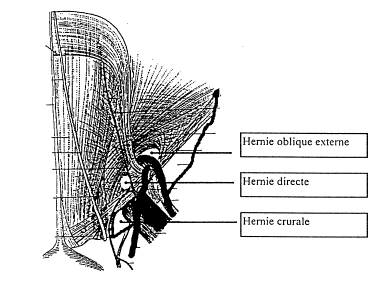
Fig. 1 : Anatomie chirurgicale du canal inguinal :
les trois types de hernies sont fléchés.
2. Hernie inguinale directe
La hernie inguinale directe traverse le fascia
transversalis au niveau de la fossette inguinale moyenne entre l’artère
ombilicale oblitérée et l’artère épigastrique, en face de l’orifice externe du
canal inguinal. Elle ne devient que rarement scrotale. Le sac n’est pas dans le
cordon spermatique et est aisément clivable de celui-ci. La pathogénie est
différente. Il s’agit d’une véritable faiblesse ou d’un affaiblissement
secondaire (même chez les sportifs) de la sangle inguinale.
3. Hernie crurale
La hernie crurale glisse sous l’arcade crurale en
suivant les vaisseaux lymphatiques et devient sous-cutanée dans le triangle de
Scarpa. Elle concerne plus la femme.
B. REGION
SUPERIEURE DE LA PAROI ABDOMINALE ANTERIEURE
1. Hernies ombilicales
a. Hernies
ombilicales (voir cours de chirurgie pédiatrique, vol. 2)
Chez l’enfant, une hernie ombilicale peut se développer
dès la naissance ou dans les premiers mois de la vie. Elle est due à la
fermeture imparfaite de l’orifice ombilical. Très souvent, l’orifice se referme progressivement avec guérison
spontanée de la hernie.
Chez
l’adulte,
l’orifice ombilical peut être faible. Sous l’effet de la pression
intra-abdominale, il s’élargit progressivement. La hernie renferme d’abord de
l’épiploon et par la suite, éventuellement, du grêle ou du côlon. Dans ce cas,
le viscère est recouvert par la peau, la cicatrice ombilicale, le péritoine et
du tissu adipeux.
2. Hernies épigastriques
La hernie épigastrique est une hernie de la ligne
blanche située entre l’appendice xiphoïde et l’ombilic. Elle s’insinue par un
des orifices de passage des vaisseaux perforants. De petite taille, cette
hernie ne contient que de la graisse sous-péritonéale ou de l’épiploon.
3. Diastasis des muscles droits
Le diastasis des muscles droits est un écartement de
muscles grands droits par distension progressive de la ligne blanche. Il se
voit surtout chez la femme après des grossesses répétées. L’espace entre le
bord interne des muscles droits peut atteindre 8 à 10 cm.
4. Hernie semi-lunaire de Spiegel
Ce type de hernie, perçant la ligne semi-lunaire,
est très rare.
C. PAROI
POSTERIEURE
Les hernies postérieures, passant par le
quadrilatère de Grynfelt ou par le triangle de Jean-Louis Petit sont
exceptionnelles.
D. PAROI
INFERIEURE
Des hernies congénitales peuvent se produire par
agénésie des releveurs ou des ischio-coccygiens. Elles peuvent également se
produire par les orifices ischiatiques et obturateurs. Toutes ces formes sont
rares.
E. PAROI
SUPERIEURE
Divers types de hernies diaphragmatiques peuvent
être observées.
1. Hernie hiatale
La hernie hiatale est la plus fréquente des hernies
diaphragmatiques. Elle est due à un élargissement de l’hiatus œsophagien,
responsable de la pénétration d’une partie de l’estomac dans la cavité
thoracique. Le cardia peut rester fixé sous le diaphragme ou glisser dans la
cavité thoracique. Parfois, d’autres organes abdominaux accompagnent l’estomac
dans le thorax.
La classification des hernies hiatales et leur
présentation clinique interfèrent avec la prise en charge du reflux
gastro-oesophagien.
2.
Hernie de Morgagni
La hernie de Morgagni est située au niveau de la
fente de Morgagni entre les faisceaux diaphragmatiques costal et sternal. C’est
par cet orifice que les vaisseaux épigastriques rejoignent les mammaires
internes.
3. Hernies traumatiques (présentation tardive du
traumatisme)
La plupart des hernies diaphragmatiques traumatiques
impliquent la partie tendineuse de l’hémi-diaphragme gauche. A droite, le lobe
droit du foie protège le diaphragme. Si la déchirure est importante, un ou
plusieurs organes intra-abdominaux passent dans le thorax, provoquent des
troubles respiratoires et des troubles du transit digestif. Ces lésions sont
souvent accompagnées d’hémorragies intrathoraciques ou intra-abdominales
importantes. Le traumatisme n’entraîne parfois qu’une petite déchirure du
diaphragme. La hernie se développe alors progressivement et ne deviendra
symptomatique que beaucoup plus tard.
II. ETIOLOGIE
Plusieurs facteurs conditionnent le développement ou
les caractéristiques d’une hernie.
|
Facteur |
Commentaire |
|
Congénital Racial Sexuel Age Pathologie associée |
H inguinale indirecte, ombilicale, hiatale, ... H ombilicale chez la race noire Fréquence accrue de HI indirecte chez l’homme et
de H crurale chez la femme. Affaiblissement musculaire Augmentation pression intra abdominale (obésité,
ascite, traumatisme, COPD...) Affaiblissement musculaire précoce (obésité,
intervention chirurgicale, malnutrition, …) |
III. MANIFESTATIONS CLINIQUES ET DIAGNOSTIC
A. SIGNES
GENERAUX
Le diagnostic des hernies externes est dans la
majorité des cas basé exclusivement sur l’examen clinique.
1. Signes directs
Le malade ressent une gêne ou une douleur
d’intensité variable au niveau de la hernie. Ce sont souvent les petites qui
sont les plus douloureuses. A un stade avancé, le malade perçoit la présence
d’une masse.
L’examen physique révèle la présence d’une tuméfaction molle, souvent indolore.
Après réduction de la hernie, on peut palper l’orifice herniaire.
2. Signes indirects
La traction sur l’épiploon ou sur les viscères
contenus dans le sac herniaire peut provoquer des douleurs rapportées. Comme toutes les douleurs d’origine viscérale,
elles sont rapportées à la région épigastrique. Les hernies ombilicales et
épigastriques, voire les hernies crurales peuvent donc provoquer des douleurs
analogues à celles de l’ulcère gastrique ou de la lithiase vésiculaire. Les
hernies crurales peuvent provoquer des symptômes urinaire si une corne vésicale
pénètre dans le sac. Il peut donc apparaître de la pollakiurie, de la dysurie.
B. LA
HERNIE INGUINALE
La propédeutique dépend du type de présentation.
La présentation froide
L’inspection permet de constater la présence d’une
masse au niveau du pli inguinal. Elle peut être invisible en position couchée
et requérir la position debout ou la manœuvre de Valsalva. Lorsque le malade
tousse, cette masse augmente de volume. La palpation révèle que la masse est
molle, indolore et réductible. Il faut repérer l’arcade crurale (de l’E.I.A.S à
l’épine du pubis). Pour terminer, il faut explorer le canal inguinal en y introduisant
l’index. Cette manœuvre permet parfois de faire le diagnostic différentiel
entre une hernie directe et indirecte externe et d’apprécier le diamètre et la
solidité des tissus du canal inguinal. Ne pas oublier d’explorer les deux
canaux inguinaux car les hernies sont souvent bilatérales.
L’étranglement
Il se traduit par la présence d’une masse bien
délimitée, douloureuse et irréductible. La peau est parfois rouge et chaude. Le
diagnostic se fait sur la base des antécédents (qui ne sont cependant pas
toujours présents) et l’association avec un syndrome d’occlusion intestinale
(qui peut manquer lorsque la hernie ne contient que l’épiploon ou qu’une anse
grêle n’est que partiellement étranglée).
L’étranglement provoque une oblitération progressive
des vaisseaux de l’organe hernié. Celle-ci entraîne d’abord une congestion par
stase veineuse, puis une ischémie par stase artérielle et enfin, une nécrose
(gangrène) avec, éventuellement, perforation. L’étranglement provoque souvent
une occlusion intestinale. Dans certains étranglements, l’intestin ne s’engage
que partiellement dans la hernie et il en résulte un pincement latéral de
l’anse. Lorsque la partie pincée se nécrose, une péritonite généralisée
apparaît sans qu’il y ait eu, au préalable, d’obstruction intestinale.
La fréquence de l’étranglement est très variable
suivant les types de hernies. Ce sont les petites hernies qui s’étranglent le
plus fréquemment. Dans les hernies volumineuses et anciennes, le port d’un
bandage favorise le développement d’étranglements.
En l’absence d’intervention, l’évolution est fatale,
soit par obstruction, soit par péritonite.
L’absence de réductibilité d’une hernie n’implique
pas qu’elle soit étranglée. Dans les volumineuses hernies chroniques chez les
obèses, le volume des viscères intra-abdominaux peut être tel que la hernie ne
peut être réduite par manque de place. Dans d’autres cas, des adhérences se
développent dans le sac herniaire, empêchant la réduction. Enfin, les hernies
par glissement sont toujours irréductibles. L’irréductibilité herniaire est
souvent mal tolérée et favorise l’étranglement.
Les hernies par glissement et les hernies
incarcérées (engouées) sont réductibles mais non douloureuses et non
accompagnées de signes inflammatoires ou de signes d’occlusion ou non
intestinale.
Forme occlusive
Le tableau clinique peut consister, surtout chez
l’obèse, à une occlusion intestinale. C’est pourquoi la hernie inguinale fait
partie des DD de l’Abdomen aigu. Il peut s’agir d’une simple constipation ou d’un
véritable arrêt des selles et des gaz. Les vomissements et une déshydratation
peuvent compliquer le tableau clinique.
Diagnostic différentiel des masses du canal
inguinal
Les signes cliniques de la hernie inguinale sont
applicables dans la forme inguino-scrotale. Ici, le diagnostic différentiel
avec hydrocèle se pose.
|
Kyste du cordon |
Hernie inguino-scrotale |
Hydrocèle |
Tumeur testiculaire |
Adénopathie inguinale |
|
|
Douleur Réductibilité Palpation testiculaire Transillumination Déformation du pli abdomino-inguinal Echographie Symptômes digestifs Valsalva |
- - N - +/- Contributive - - |
+/- (si
étran-glement) +/- + (si étranglée) - + Aléatoire + (étranglement) + |
- - -/malaisée ++ - Contributive - - |
+/- - +/- - - Contributive - - |
+/- - N - - Contributive - - |
C. LA
HERNIE CRURALE
1. Hernies non-étranglées
Le malade se plaint d’une douleur de la région
inguinale et constate parfois la présence d’une voussure.
L’examen en position debout révèle parfois la présence
d’une masse située à la partie haute du triangle de Scarpa. Elle est molle et
réductible. La localisation de la ligne de Malgeigne et l’introduction du doigt
dans le canal inguinal permettent de confirmer que la masse est indépendante de
ce dernier. Dans de nombreux cas, la hernie n’est pas palpable malgré un examen
attentif.
Le seul diagnostic différentiel à rechercher est
celui de la dilatation de la crosse de la saphène qui, comme la hernie, se
traduit par une masse molle réductible et augmentant à la toux. On se basera
sur l’association avec des varices et éventuellement par la couleur bleutée de
la tumeur. Le caractère de la tumeur à la palpation est également différent.
Dans le cas d’une saphène dilatée, la percussion de la saphène à la cuisse se
répercute au niveau de la masse. La hernie crurale peut être prise pour un
lipome de la cuisse.
2.
Hernies étranglées
La hernie crurale étranglée se traduit par la présence d’une tumeur dure, douloureuse et irréductible dans le triangle de Scarpa. Il existe, en général, des signes inflammatoires et parfois des signes d’occlusion intestinale. Très souvent, le malade n’était pas conscient de la présence d’une hernie et l’étranglement en est la première manifestation. Le diagnostic différentiel doit envisager la présence d’un ganglion inflammatoire ou tumoral ou d’une thrombose de la crosse de la saphène. Ce diagnostic différentiel se fait en se basant sur le contexte clinique. La présence d’adénopathies généralisées ou d’une lésion inflammatoire des membres inférieurs ou du périnée permet de poser le diagnostic d’adénopathie. La présence de signes d’occlusion intestinale évoque celui de hernie étranglée. Dans certains cas, le diagnostic différentiel clinique est impossible. Il faut alors recourir à l’exploration chirurgicale.
D.
HERNIES INTERNES (pelviennes, de Morgagni, etc.)
Elles ne se manifestent jamais ou très tardivement sous forme d’une masse palpable. Les signes indirects signalés ci-dessus sont souvent les seuls symptômes. En général, ces hernies ne deviennent symptomatiques que lorsqu’elles s’étranglent et provoquent une obstruction intestinale.
E. LES HERNIERS HIATALES
La hernie hiatale correspond anatomiquement et étymologiquement à la définition des hernies. Cependant, sa présentation clinique et ses implications en pathologie n’ont aucun rapport avec la hernie inguinale. Les anomalies anatomiques de l’orifice hiatal concernent la pathologie oesogastrique, le reflux gastro-oesophagien en particulier. La mise au point, la classification des hernies hiatales et leur traduction clinique seront donc présentées dans le cadre de la pathologie oesogastrique.
F. LES EVENTRATIONS
Toute incision opératoire de la paroi abdominale peut conduire à une éventration. Que ce soit une suture par points espacés, une résorption trop rapide des fils, un hématome ou un abcès de paroi, une déchirure sous l’effet de la toux ou d’un mouvement brutal, un petit défect peut s’élargir considérablement. Si l’éventration est précoce (1 à 6 mois), on invoque plus volontiers un problème postopératoire précoce. Si la faiblesse apparaît après un an ou plus, il faut se pencher sur la qualité de la musculature ou des variations de poids trop rapides. Une prise de poids ou un amaigrissement significatif accentue la symptomatologie de l’éventration. Chez l’obèse ou le patient multi-opéré, la tomographie axiale peut être nécessaire pour préciser le diagnostic clinique. La topographie guide le traitement chirurgical. Celui-ci est pratiquement systématique parce que l’étranglement est extrêmement dangereux. Dans des cas étendus, le chirurgien recourt en général à la mise en place d’une prothèse non résorbable conjuguée à la fermeture aponévrotique. Qu’elle soit en teflon, marlex, mersylène ou goretex, une prothèse pariétale doit rester extrapéritonéale sous peine de lésions intestinales irréversibles lors de réinterventions.
G. L’EVISCERATION
Il s’agit de la déhiscence postopératoire précoce de la plaie et des 3 feuillets musculo-aponévrotiques, péritonéaux et cutanés. En quelques minutes, les viscères sont exposés à l’air. Il s’agit d’une urgence opératoire impérieuse. Le sepsis et le choc guettent le patient.
IV. TRAITEMENT
Chez l’adulte, le traitement est chirurgical sauf exceptions (contre-indications opératoires majeures).
1.
Principes de traitement de
la hernie inguinale
Hernie inguinale indirecte
La résection du sac intra-funiculaire est la règle de base pour l’immense majorité des cliniques. La fermeture du canal inguinal, selon des modalités diverses complète l’intervention. Depuis peu, la mise-au-point de techniques mini-invasives appuie un nouveau concept. Au lieu de réséquer le sac péritonéal, on peut l’invaginer en y fixant une prothèse en forme d’ombrelle qui se déploie pour oblitérer le défect.
Hernie inguinale directe
La faiblesse du fascia
transversalis et le glissement direct nécessitent souvent, surtout chez le
patient âgé, la mise en place d’une prothèse de marlex, téflon ou goretex ou
d’un matériel expansible.
Hernie étranglée
La réduction précoce par le
médecin traitant ou au service des Urgences s’impose.
Chez l’adulte, plus de 90%
des hernies inguinales et inguino-scrotales sont réductibles en urgence. Le
patient doit être allongé confortablement après l’administration orale ou
intra-veineuse d’un antalgique non morphinique. Si la hernie inguinale est
droite et concerne l’homme, la main droite du médecin empaume la bourse et
imprime un mouvement lent et progressif vers l’orifice externe. Simultanément,
la main gauche comprime le trajet funiculaire. La réduction est lente et
constante. Les pressions alternées permettent de chasser le contenu intestinal
et le liquide associé dans le sac herniaire. Soudain, après quelques minutes,
la hernie se réduit. On peut ensuite suivre le patient de près pendant 36
heures ou l’hospitaliser pour réaliser secondairement une cure chirurgicale. Le
risque de récidive est élevé. Si le patient est en occlusion digestive, la
réduction doit également être précoce par le médecin clinicien qui fait le
diagnostic. L’hospitalisation s’impose pour suivre l’évolution abdominale
éventuelle par l’abdomen à blanc ou tomographie axiale.
Une suspicion clinique,
biologique ou radiologique d’ischémie mésentérique conduit à une laparotomie
d’emblée. La résection grêle ou sigmoïdienne peut être nécessaire.
2.
Alternatives techniques en
cas de hernie inguinale
Selon le type de patient et de hernie, les convictions intellectuelles du chirurgien et le contexte économique, trois grands abords chirurgicaux doivent être mentionnés et seront rencontrés par le médecin généraliste.
Abord inguinal (Shouldice ou Plug)
L’incision est inguinale oblique et à l’aplomb du canal inguinal.
Abord coelioscopique
Trois
trocards permettent l’insufflation pré- ou intra-péritonéale de CO2.
Abord médian selon STOPPA
Mise
en place d’une prothèse de marlex bilatérale.
Quatre techniques sont probablement complémentaires
plutôt que concurrentes bien que peu d’équipes chirurgicales soient capables
d’offrir l’éventail complet de la technologie.
|
|
Shouldice |
« tension free » + plug |
Stoppa |
Coelio-(prépéritonéal) |
|
Anesthésie C. Ambulatoire Douleur postop. Hospitalisation Délai effort physique Esthétique Recul (ans) Coût total |
LRN Oui ++ 1-3 6 sem moyen 20 + |
LRN Oui + 1-3 3 sem. moyen 3 ++ |
N Non +++ 4-6 8 sem. faible 15 ++ |
N Non + 2-3 3 sem. très bon 5 +++ |
L = locale R = régionale N = narcose
a.
La herniographie selon Shouldice
Il s’agit d’un abord inguinal conventionnel, de la résection du sac herniaire et d’une reconstruction en trois plans (fascia transversalis, tendon conjoint, grand oblique) sur le ligament de Cooper de l’arcade inguinale. Cette technique a remplacé les techniques obsolètes (Bassini, Mac Vay, …).
Les avantages de cette technique sont les
suivants :
-
le
sac est réséqué,
-
la
cure est rétro-funiculaire,
-
l’intervention
peut se faire sous loco-régionale ou en ambulatoire
-
le
résultat à long terme est connu (de O.5 à 2 % de récidive).
b. La herniographie inguinale avec PLUG
Le défect est disséqué parfaitement. Le sac direct ou indirect est fixé à une ombrelle en silastic et enfoui. Cet abord s’avère encore moins douloureux que le Shouldice. Le recul fait défaut.
c. La voie médiane de Stoppa
Partant du principe de bilatéralité fréquente, le chirurgien peut aborder les deux creux inguinaux par une voie médiane pré-aponévrotique. Appliquée plus volontiers à la hernie directe chez le patient âgé, l’intervention consiste en la mise en place d’une grande plaque comblant les deux canaux inguinaux en laissant passer les deux cordons spermatiques par des incisions latérales. La technique est plus délabrante, plus douloureuse mais très efficace. Elle est en général proposée dans les affaiblissements musculaires graves et dans les récidives. Le taux de récidive est en général inférieur à 2%.
d. La voie coelioscopique
Par voie trans-péritonéale (abandonnée à cause des complications
intra-péritonéales) ou pré-péritonéale (dissection pariétale par CO2), les
orifices inguinaux peuvent être visualisés par une optique – caméra –
introduite par un trocart médian. Les deux prothèses expansives sont alors
insérées sans résection du sac herniaire. Cette technique est en général peu
douloureuse et satisfaisante pour certaines équipes. Il n’existe aucun recul
disponible et une certaine morbidité a été notée en début d’expérience.
Le principe de la pose prépéritonéales d’une
prothèse la rapproche du Stoppa. Elle est peu douloureuse et permet un
recouvrement et une convalescence réduits.
I. MANIFESTATIONS CLINIQUES
Les principaux symptômes rencontrés dans les malades de l’œsophage sont : la dysphagie, le pyrosis et la douleur thoracique.
A.
LA DYSPHAGIE
1.
La dysphagie
œsophagienne
La dysphagie œsophagienne désigne une sensation d’arrêt des aliments solides ou liquides, immédiatement après leur ingestion. Le malade a l’impression que les aliments restent « bloqués ».
On reconnaît deux catégories de dysphagies œsophagiennes : les dysphagies dues à un obstacle mécanique et les dysphagies associées à une altération de la fonction neuro-musculaire (tableau 1).
Certaines particularités peuvent aider au diagnostic
étiologique d’une dysphagie sans pour autant être absolues. Une dysphagie progressive pour les solides
puis pour les liquides, à aggravation rapide, est, le plus souvent, d’origine
cancéreuse. Une dysphagie à évolution lente précédée ou associée à du pyrosis
plaide en faveur d’une œsophagite de reflux avec sténose. L’achalasie provoque
généralement une dysphagie à évolution capricieuse aussi bien pour les liquides
que pour les solides. Dans les spasmes œsophagiens diffus, la dysphagie
accompagne souvent un épisode douloureux aigu.
2.
La dysphagie
oropharyngienne
Elle se caractérise par l’impossibilité de faire passer les aliments de la bouche dans l’œsophage. Elle s’accompagne parfois de régurgitations nasales, de toux lors de la déglutition, de sensation d’étouffement et d’une élocution nasale par faiblesse musculaire.
Les principales causes de dysphagie oropharyngienne figurent dans le tableau II.
3.
L’odynophagie
L’odynophagie est une sensation douloureuse, survenant au niveau de la région rétrosternale lors de la déglutition. Les principales causes d’odynophagie figurent dans le tableau III.
|
TABLEAU I : ETIOLOGIES DE LA
DYSPHAGIE OESOPHAGIENNE |
|
A.
OBSTACLES
MECANIQUES 1) Intrinsèques - Cancers - Sténose peptique, caustique ou radiothérapique -
Anneau de Schatski -
Tumeurs bénignes -
Corps étrangers -
Diverticule -
Sclérodermie 2)
Extrinsèques -
Compression vasculaire (anévrisme aortique, artéria
lusoria) -
Lésions médiastinales (tumeurs, adénopathies) -
Eperons osseux (arthrose) B.
TROUBLES DE LA
FONCTION NEURO-MUSCULAIRE Achalasie Anomalies motrices du corps œsophagien - Spasmes œsophagiens diffus - Œsophage « casse noisette » - Troubles moteurs non spécifiques |
|
TABLEAU II : ETIOLOGIES DE LA
DYSPHAGIE OROPHARYNGIENNE |
|
A. OBSTACLES MECANIQUES (20%) -
Inflammatoires :
pharyngite, abcès, tuberculose -
Tumeurs -
Diverticule de Zenker -
Spasme
du muscle crico-pharyngien -
Séquelle
de radiothérapie A. TROUBLES DE LA FONCTION NEURO-MUSCULAIRE (80%) 1)
Système nerveux central -
Accident
vasculaire cérébral -
Maladie
de Parkinson -
Sclérose
en plaque -
Sclérose
latérale amyotrophique 2)
Système nerveux
périphérique -
Poliomyélite -
Neuropathies 3)
Système musculaire -
Dystrophies
musculaires -
Myopathies
métaboliques -
Amyloïdose -
Lupus
érythémateux |
TABLEAU III : ETIOLOGIES DE L’ODYNOPHAGIE |
LESIONS DE LA MUQUEUSE OESOPHAGIENNE -
Œsophagite de
reflux : acide, biliaire -
Œsophagites
infectieuses : virales (CMV, Herpès), bactériennes (tuberculose),
mycotiques (candida) -
Œsophagites
médicamenteuses : tétracyclines, AINS, quinidine, diphosphonate -
Œsophagites
inflammatoires : caustique, radique, maladie de Crohn -
Néoplasmes |
4.
Le « globe
hystérique »
La sensation de la présence
« d’une boule dans la gorge » survient chez des malades hystériques,
dépressifs ou obsessionnels. Avant d’accepter ce diagnostic, il faut exclure la
présence d’une lésion organique ou fonctionnelle.
B. LE PYROSIS
Le terme pyrosis doit être réservé à une sensation de brûlure ou de chaleur
rétrosternale, intermittente, irradiant fréquemment vers la région
pharyngienne. Il peut être accompagné d’un reflux dans la bouche d’un liquide
acide ou plus souvent amer. Il est souvent calmé par l’ingestion d’antiacides
et aggravé par les aliments sucrés, le café et l’alcool.
Il est en général dû à un reflux gastro-oesophagien.
Le fait qu’il survienne lors du décubitus (la nuit) ou lorsque le malade se
penche en avant est caractéristique d’un tel reflux. Plus rarement, le pyrosis
est la manifestation de troubles moteurs œsophagiens.
C. DOULEUR
THORACIQUE D’ORIGINE OESOPHAGIENNE
Il existe deux types de douleurs d’origine
œsophagiennes :
-
L’odynophagie précédemment décrite.
-
La douleur rétro-sternale d’apparition brutale sans relation avec la
déglutition. L’irradiation interscapsulaire lorsqu’elle est présente est
caractéristique. Elle peut simuler l’angor coronarien. Elle s’en distingue
généralement par l’absence d’irradiation vers les bras, l’absence de relation
avec l’effort et une durée plus longue. Les causes les plus fréquentes de ce
type de douleur sont les troubles moteurs et le reflux gastro-oesophagien
(Tableau IV).
|
TABLEAU IV : ETIOLOGIES DES DOULEURS RETRO-STERNALES |
|
CARDIO-VASCULAIRES Ischémie myocardique Anévrisme ou dissection chronique de l’aorte DIGESTIVES Reflux gastro-oesophagien Troubles moteurs de l’œsophage Ulcère gastro-duodénal Colique biliaire MUSCULO-SQUELETTIQUE Syndrome de Cyriax, de Titze et Xyphoïdynie PSYCHO-SOMATIQUES Aérophagie, Hyperventilation, Panique |
D. LA REGURGITATION
Ce terme doit être réservé à
l’évacuation brutale de liquides ou de solides accumulés en amont d’une sténose
œsophagienne organique ou fonctionnelle. Elle se distingue des vomissements par
l’absence de nausées prémonitoires, l’absence de sécrétion acide bilieuse et la
présence d’aliments non digérés.
Elle peut survenir soit
immédiatement, soit plus tardivement après la déglutition. Dans ce dernier cas,
elle est le témoin d’un trouble moteur grave, d’une rétention alimentaire en
amont d’un obstacle.
E. L’ERUCTATION
L’éructation est une
régurgitation forcée d’air. Elle donne une fausse impression de confort. Comme
elle est associée à une déglutition d’air, un cercle vicieux peut aisément
s’installer.
Ce symptôme est, en général,
rencontré chez des sujets névropathiques. Il peut néanmoins être observé dans
certaines affections œsophagiennes, gastriques ou chez des patients atteints
d’insuffisance coronaire. L’éructation peut être le témoin d’une hyper-activité
vagale.
F. EXTRA-OESOPHAGIENNES
Les symptômes suivants
peuvent être liés à un reflux gastro-oesophagien :
respiratoires (toux
nocturnes, broncho-pneumopathies à répétition, asthme) ;
ORL (raucité de la voix,
otalgies, fausse angine).
II. METHODES D’EXPLORATION
L’exploration de l’œsophage
poursuit 2 buts : la mise en évidence d’une lésion et l’investigation d’une
anomalie fonctionnelle : motrice ou sphinctérienne.
A. MISE EN EVIDENCE DUNE LESION
1. Fibroscopie
Les endoscopes souples
permettent l’examen en vue directe de tout l’œsophage, de l’estomac et du
duodénum. L’examen ne nécessite qu’une anesthésie locale et éventuellement une
légère prémédication. La morbidité et la mortalité sont quasi nulles.
Ses principales indications
sont de deux ordres :
a. Diagnostique
La fibroscopie est, en
général, indispensable en cas de suspicion de pathologie œsophagienne. Ce sera
souvent le premier examen réalisé. Outre
l’examen des modifications de la surface muqueuse, elle permet la réalisation
de biopsies et de frottis destinés à des examens cytologiques ou
microbiologiques.
b. Thérapeutique
·
extraction
de corps étrangers ;
·
dilatation
de sténoses organiques ou fonctionnelles ;
·
mise
en place de prothèses en cas de sténose néoplasique ;
·
traitement
de lésions hémorragiques.
2. Imagerie
a. Rx thorax
La radiographie du thorax
révélera éventuellement une augmentation de volume du médiastin, un goitre
longeant, la présence d’air dans la région rétro-cardiaque (caractéristique
d’une hernie hiatale volumineuse). On vérifiera également l’absence éventuelle
de la poche d’air, signe observé dans l’achalasie.
b. Transit
oeso-gastro-duodénal (OED)
Il permet d’obtenir une
imagerie dynamique de l’œsophage et de l’estomac en ambulatoire sans aucune
sédation. L’examen permet de déceler une sténose, intrinsèque ou extrinsèque,
un polype, un corps étranger et suivant les anomalies anatomiques :
-
diverticule
de Zenker ;
-
diverticule
œsophagien inférieur ;
-
hernie
hiatale de type I à III ;
-
reflux
lors du procubitus ;
-
contrôle
postopératoire.
Cet examen est très utile
dans le cadre d’une chirurgie œsophagienne.
La cinématographie de
déglutition
Elle consiste en une
exploration dynamique au cours de l’ingurgitation d’un produit de contraste.
Elle identifie l’espace œsophagien diffus, les troubles de la jonction
oeso-gastrique et éventuellement un spasme du cricopharyngé.
c. La tomodensitométrie
Elle évalue les lésions
médiastinales, l’extension d’une tumeur œsophagienne ; elle recherche les
petites métastases pulmonaires, les adénopathies médiastinales et cœliaques et
les métastases hépatiques.
3. Echo-endoscopie
Cet examen comporte
l’association d’un endoscope et d’une source ultra sonore. On obtient des
coupes anatomiques perpendiculaires à l’axe de l’endoscope. Il met en évidence
:
·
la
profondeur de l’infiltration cancéreuse par l’étude des 5 couches de l’œsophage
: muqueuse, muscularis mucosae, sous-muqueuse, musculaire propre et adventice ;
·
la
détection d’adénopathies régionales ;
·
la
présence de tumeurs sous-muqueuses ;
·
la
détection de compression extrinsèque
B. INVESTIGATION D’UNE MALADIE FONCTIONNELLE
1. La phmétrie
œsophagienne
La mesure de pH œsophagien
s’effectue au moyen d’une microélectrode introduite dans l’œsophage, 5 cm en
amont des sphincters gastro-oesophagiens inférieurs. Divers procédés permettent
la réalisation d’une phmétrie continue durant 24 heures et donc la mesure de la
fréquence et de la durée des épisodes de reflux.
L’analyse de
l’enregistrement permet d’évaluer des résultats
quantitatifs (nombre d’épisodes de reflux acide, % de temps durant lequel
le pH est < à 4) et qualitatifs
(corrélation des symptômes et des épisodes de reflux par un marqueur
d’événements : repas, lever, coucher, symptômes, etc...).
Les principales indications
de la méthode sont :
·
L’étude
de malades présentant des signes atypiques de reflux gastro-oesophagien.
·
L’étude
des patients présentant des signes typiques de reflux gastro-oesophagien, mais
chez lesquels l’endoscopie est négative.
·
Les
malades candidats à un traitement chirurgical dont on doit formellement exclure
une dissociation reflux-symptômes.
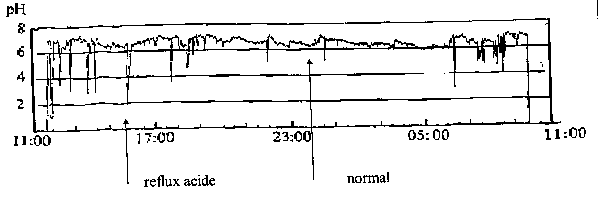
Fig. 2 : Phmétrie de 24 heures montrant les chutes de pH.
2. La manométrie
œsophagienne
Deux types de contractions
sont observées :
·
le
péristaltisme primaire provoqué par la déglutition ;
·
le
péristaltisme secondaire qui naît localement dans l’œsophage lorsqu’on le
distend.
Entre les déglutitions,
l’orifice œsophagien supérieur est fermé et la pression élevée du sphincter
œsophagien inférieur empêche le reflux des sécrétions gastriques ou biliaires.
Lors de la déglutition, la pression régnant à l’orifice œsophagien supérieur
diminue, des ondes péristaltiques se propagent tout le long de l’œsophage et le
sphincter œsophagien inférieur se relâche. L’ensemble de ces activités est sous
la dépendance des innervations extrinsèques et intrinsèques, ainsi que des
facteurs hormonaux et humoraux. La pression du sphincter œsophagien inférieur
peut varier sous l’influence de divers aliments et de médicaments.
La manométrie est le procédé de choix pour explorer la motricité
œsophagienne.
Une sonde, munie de multiples capteurs de pression, introduite dans l’œsophage
permet la mesure de pression à différents niveaux de celui-ci, tant au repos
qu’au cours de la déglutition. Elle permet de déterminer le tonus et la
résistance des sphincters pharyngo-oesophagiens et gastro-oesophagiens. Cet
examen est indispensable pour l’étude des troubles fonctionnels de l’œsophage.
Il peut être couplé à la phmétrie de 24 heures.
*

Fig. 3 : Manométrie normale : * représente le début de la déglutition.
3. L’exploration de la vidange gastrique par scintigraphie
Elle se fait par marquage d’éléments solides par un radioélément, permettant de suivre leur devenir dans l’estomac.
I. MALADIES AFFECTANT LA
MOTRICITE OESOPHAGIENNE
A. RELAXATION INADEQUATE
SPINCTERIENNE
! Sphincter oesophagien inférieur :
ACHALASIE
1. Définition et
anatomopathologie
L’achalasie encore appelée
cardiospasme est caractérisée par deux troubles moteurs œsophagiens : une perte du péristaltisme des muscles des
2/3 inférieurs de l’œsophage et une relaxation incomplète du sphincter
œsophagien inférieur.
Du point de vue
anatomopathologique, l’affection se caractérise par une dégénérescence des cellules ganglionnaires (dont le neurotransmetteur
est le VIP et le NO) dans les plexus myentériques, responsable d’une perte
de l’innvervation inhibitrice aboutissant à un épaississement de la paroi
musculaire.
Il existe des formes
secondaires d’achalasie (pseudo-achalasie) qui sont associées à une lésion
infiltrante de la jonction gastro-oesophagienne. Il s’agit le plus souvent d’un
adénocarcinome ou d’un lymphome. Des cas similaires peuvent être observés dans
la maladie de Chagas provoquée par le trypanosome Cruzi qui, au cours de la phase
chronique de la maladie, aboutit à une destruction des cellules ganglionnaires
non seulement de l’œsophage mais également du côlon et des uretères.
2. Manifestations
cliniques
Le début des symptômes se
situe habituellement entre 30 et 50 ans.
Tous les patients ont une dysphagie pour les solides ; la
majorité d’entre eux ont également une dysphagie de degré variable pou les liquides surtout froids. La dysphagie
peut être provoquée par les émotions.
Au début de l’évolution, la dysphagie est fluctuante puis atteint un plateau
stable.
Des régurgitations consistant en aliments ingérés plusieurs heures
avant sans goût ni bilieux ni acide sont présentes dans 80% des cas. Certains
patients provoquent des régurgitations en vue d’améliorer la gêne rétrosternale.
Les régurgitations peuvent être nocturnes, favorisées par le décubitus et être
accompagnées de toux.
Une douleur thoracique est observée dans 60% des cas, principalement au
début de l’évolution. Elle est souvent précipitée par l’ingestion d’un repas et
peut être nocturne.
Une perte de poids peut être présente tardivement.
3. Complications
Des complications broncho-pulmonaires secondaires à la régurgitation et
à l’aspiration d’aliments dans l’arbre bronchique surviennent chez près de 10%
des malades.
Le risque de dégénérescence néoplasique est non
négligeable. Il s’agit le plus souvent de carcinomes épidermoïdes ou plus
rarement d’adénocarcinomes.
4. Diagnostic
Une oesophagoscopie sera pratiquée. L’endoscope franchit aisément le
cardia. La muqueuse est généralement normale.
La radiographie du thorax,
normale dans les formes débutantes, peut montrer dans les formes avancées un
élargissement du médiastin et un niveau hydro-aérique rétro-trachéal. A ce
stade on peut observer une absence de poche à air (20% des cas). Des infiltrats
pulmonaires doivent être recherchés.
Le transit baryté montre une
dilatation de l’œsophage dont l’importance dépend du degré d’évolution et une
sténose distale en bec d’oiseau.
Ces examens seront complétés par une manométrie.
Deux critères sont retenus :
·
Une relaxation incomplète du
sphincter œsophagien inférieur.
·
Une
absence de péristaltisme œsophagien propagé.
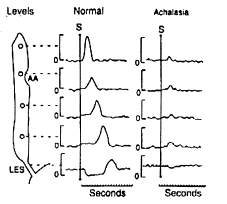
Fig. 4 : Manométrie dans l’achalasie.
5. Traitement
a. Médicaments
Le dinitrate d’Isosorbide (Cédocard â) et la Nifédipine (Adalat â) provoquent une relaxation du sphincter
œsophagien inférieur, mais leur effet thérapeutique est limité et de courte
durée.
b. Injection intra-sphinctérienne de toxine botulinique par
voie endoscopique
Cette injection diminue l’hypertonie sphintérienne. L’effet est souvent de courte durée.
c. Dilatation
du cardia réalisée au moyen d’un ballon par voie endoscopique
La dilatation du cardia est réalisée au moyen d’un ballon placé sous contrôle scopique au niveau du cardia et gonflé rapidement (dilatation pneumatique). Le procédé est généralement pratiqué sous narcose. Une perforation de l’œsophage peut survenir dans environ 1% des cas. La réalisation, de principe, d’un transit à la gastrografine permet de déceler rapidement cette complication. Lorsque la perforation est petite ou couverte, elle peut-être traitée médicalement (aspiration naso-gastrique, atropiniques, alimentation parentérale et antibiotiques). Dans les autres cas, une intervention chirurgicale s’impose. Les résultats à long terme sont bons dans 70% des cas. De nouvelles dilatations sont parfois nécessaires, surtout chez les malades de moins de 45 ans.
c. Traitement
chirurgical
Le traitement chirurgical consiste en une cardiomyotomie (opération de Heller).
Une section longitudinale de la musculature œsophagienne entourant le cardia,
respectant la muqueuse, est réalisée. La béance du cardia provoquée par la
section des muscles circulaires peut provoquer une œsophagite de reflux (au
moins 10% des cas). Aussi, on préconise la réalisation simultanée d’une
intervention anti-reflux selon Toupet (valve à 270°) (voir traitement du reflux
gastro-oesophagien).
Chez la majorité des malades, la dilatation
pneumatique est proposée comme première méthode. Le traitement chirurgical est
proposé en cas d’échec des dilatations et en première intention chez les
malades jeunes (< 45 ans).
·
Sphincter oesophagien supérieur : SPASME DU SPHINCTER
CRICO-PHARYNGIEN
Il survient
surtout chez des vieillards. Le diagnostic sera établi par l’association de
l’endoscopie, de la manométrie et de la ciné-radiographie. Des complications
pulmonaires peuvent survenir. En cas de dysphagie oro-pharyngienne importante,
une intervention chirurgicale (myotomie cricopharyngée) sera proposée. Elle
peut se réaliser par endoscopie rigide, suivant une technique similaire à celle
utilisée pour le Zenker.
B. ANOMALIES MOTRICES DU CORPS OESOPHAGIEN
1. Définition
·
Les
contractions non coordonnées : SPASMES
OESOPHAGIENS DIFFUS
·
Les
hypercontractions : OESOPHAGE « CASSE
NOISETTE »
·
Les
hypocontractions
2. Clinique, diagnostic et traitement
|
Maladies affectant la motricité de l’œsophage |
||
|
ETIOLOGIE |
CLINIQUE |
TRAITEMENT |
|
A. Relaxation sphinctérienne Achalasie spasme
du crico-pharyngien |
dysphagie douleur thoracique dysphagie oropharyngienne |
dérivés nitrés, anticalciques, dilatation
pneumatique, toxine botulinique myotomie laser myotomie |
|
B. Corps oesophagien Spasmes
oesophagiens Oesophage
casse-noisette Hypocontractions |
douleur thoracique dysphagie douleur thoracique dysphagie douleur thoracique dysphagie |
dérivés nitrés, anticalciques dérivés nitrés, anticalciques prokinétiques |
·
Les spasmes oesophagiens
diffus
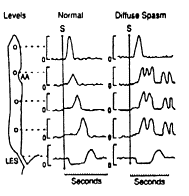
La manométrie montre une alternance d’ondes normales péristaltiques et d’ondes non péristaltiques. La durée des ondes peut être prolongée et il peut survenir des ondes non péristaltiques spontanées.
Le transit baryté de l’oesophage est normal ou montre des spasmes segmentaires (= aspect en « tire-bouchon »)
Fig. 5.
· L’œsophage « casse noisette »
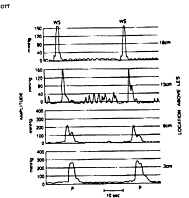
La manométrie montre des contractions péristaltiques d’amplitude élevées (> à 180 mm de Hg) au niveau de la partie distale de l’œsophage.
Les anomalies radiologiques sont les mêmes que dans les spasmes diffus.
Fig. 6.
· Les hypocontractions
Des ondes de faible amplitude
s’observent sans causes particulières ou associées à des affections telles que
sclérodermie, connectivites, diabète, pseudoobstruction, reflux
gastrooesophagien.
D. LES HERNIES HIATALES
La hernie hiatale est la plus fréquente des hernies diaphragmatiques. Elle est due à un élargissement de l’hiatus œsophagien responsable de la pénétration d’une partie de l’estomac dans la cavité thoracique. Le cardia peut resté fixé sous le diaphragme ou glisser dans la cavité thoracique. Parfois, d’autres organes abdominaux accompagnent l’estomac dans le thorax.
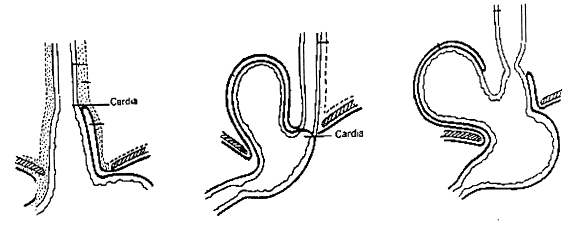
Fig. 7 : hernies hiatales ;
de g. à d., les types I à III.
Le type I, de loin le plus fréquent, comporte un glissement du cardia dans le thorax. Alors que normalement l’œsophage se continue vers l’estomac le long de la petite courbure, dans ce type de hernie hiatale, l’œsophage occupe une position centrale vis-à-vis de l’estomac. Un reflux gastro-oesophagien accompagne éventuellement ce type de hernie.
Dans le type II, le cardia est intra-abdominal. Une partie de la poche à air se glisse dans le thorax à côté de l’œsophage. Dans cette variété, les mécanismes qui préviennent le reflux gastro-oesophagien ne sont pas perturbés. Les symptômes sont liés à l’irritation des organes thoraciques voisins (palpitations, dyspnée, hoquet) et à l’étranglement de la poche herniaire dans l’orifice hiatal (douleurs).
Le type III, enfin, est une combinaison des types I et II. Une partie importante de l’estomac glisse dans le thorax, éventuellement accompagnée d’autres organes (côlon par exemple).
II. LES OESOPHAGITES
Les inflammations de l’oesophage ont 4 étiologies :
- inflammatoires : caustiques, radiques, Crohn
- infectieuses : virus, bactéries, mycoses
- médicamenteuses
- reflux acide et biliaire
A. OESOPHAGITES INFLAMMATOIRES
1. Caustiques
a. Anatomopathologie
L’œsophagite caustique est la conséquence de l’ingestion accidentelle ou volontaire d’acides ou de bases fortes utilisés habituellement comme produit ménagers (Harpic â, Destop â, eau de Javel).
La gravité des lésions tissulaires dépend de la nature, de la concentration et de la quantité du caustique.
Si l’atteinte reste superficielle, une muqueuse normale se reforme. Dans les cas plus graves, une fibrose se développe et des sténoses peuvent apparaître. Ces lésions favorisent le développement de cancers.
b. Manifestations cliniques et évolution
Pendant la phase aiguë, la douleur est le symptôme principal. Elle siège dans les régions buccale, pharyngée et rétrosternale. Elle est très violente et s’accompagne de sialorrhée et de dysphagie. Un état de choc peut être associé aux douleurs. Toute alimentation par voie orale est rendue impossible. Des vomissements peuvent aggraver les lésions œsophagiennes. La présence de dyspnée, de raucité de la voix, de stridor, est due à des lésions laryngées ou bronchiques associées. En ces de brûlures trans-pariétales avec perforation, des signes de médiastinite et/ou de péritonite (en cas de perforation gastrique) sont observés.
Les formes mineures évoluent vers la guérison sans séquelles. Dans les formes sévères, après quelques semaines, les processus de cicatrisation provoquent la réapparition d’une dysphagie due au développement de sténoses (15 à 25% des cas).
c. Conduite à venir
A) Sur les lieux
Une hospitalisation d’urgence s’impose. On recommandera la suppression de toute alimentation orale ; on traitera le choc, s’il existe et l’œdème laryngé éventuel. On recueillera le maximum de renseignements sur les circonstances de l’ingestion caustique, sa nature, et sa quantité.
B) En centre spécialisé
L’examen clinique est essentiel avec appréciation de l’état cardio-vasculaire, respiratoire et abdominal. On fera des examens biologiques et une endoscopie haute prudente qui orientera le traitement.
Traitement
1°) au cours de la phase aiguë : en fonction de l’importance des lésions endoscopiques, on s’orientera vers :
- L’absence de traitement spécifique et la reprise de l’alimentation orale (en l’absence d’ulcération)
- La chirurgie : oesophagectomie totale à thorax fermé (nécrose étendue). Le stripping permet l’exérèse de l’œsophage en le retournant en doigt de gant par une cervicotomie et laparotomie.
-
La nutrition parentérale totale dans les cas intermédiaires.
2°) au cours de la phase chronique : le risque de développement d’une sténose sera évalué par endoscopie et radiologie. Cette sténose sera dilatée au moyen de bougies. Certains patients requièrent des dilatations itératives.
Si le traitement par dilatation est insuffisant, il faut recourir au traitement chirurgical comprenant une résection de l’œsophage sténosé et son remplacement, par transposition dans le thorax de l’estomac ou du côlon.
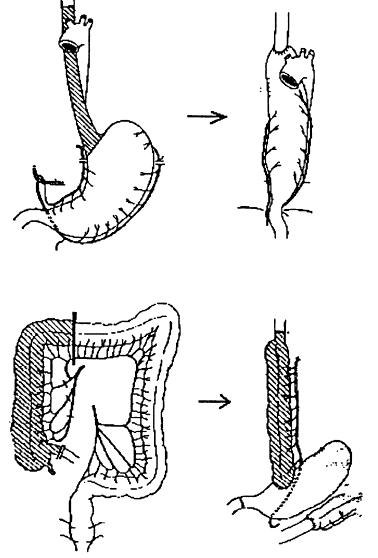
Fig. 8. Plasties œsophagiennes
2. Radiques
Une irradiation thoracique (par exemple pour un cancer bronchique) peut entraîner une œsophagite soit aiguë, durant la période de radiothérapie, soit chronique après la période de radiothérapie ; elle est alors la conséquence d’une fibrose intramurale.
Le
diagnostic est posé par l’histoire clinique et l’exclusion des autres causes
d’œsophagite.
Le traitement comporte, durant la phase aiguë, l’arrêt de la radiothérapie ou
la modification du champ d’irradiation ainsi que la prise orale de gels
anesthésiants ou d’antisécrétoires acides.
Les sténoses radiques seront traitées par dilatations endoscopiques, gastronomie ou résection chirurgicale avec interposition d’estomac ou de côlon.
3. Maladie de Crohn
La maladie de Crohn peut atteindre l’œsophage sous forme d’ulcérations discrètes de type aphtoïde.
B. OESOPHAGITES
INFECTIEUSES
Des infections virales (herpès, cytomégalovirus), bactériennes (tuberculose) ou mycotiques (candida) peuvent être responsables d’œsophagites chez les patients immunodéprimés (SIDA, greffés) ou traités par antibiotiques.
C. OESOPHAGITES MEDICAMENTEUSES
Plusieurs médicaments peuvent être responsables d’œsophagites : tétracyclines, AINS, quinidine, alendronate (= biphosphonanate).
D. OESOPHAGITES DE REFLUX
L’œsophagite de reflux représente l’ensemble des lésions inflammatoires de l’œsophage provoquées par un reflux anormalement fréquent et prolongé de matériel gastrique acide, plus rarement de liquide biliaire.
1. Anatomopathologie
Le reflux gastro-oesophagien pathologique provoque des lésions inflammatoires hyper-hémiques et érosives plus ou moins étendues situées à la partie inférieure de l’œsophage. L’examen histologique montre des images non spécifiques d’inflammation et de régénération épithéliale.
Le reflux prolongé peut conduire à la fibrose et à la formation de sténoses. Celles-ci peuvent se situer très en amont du cardia. Elles peuvent être courtes ou longues.
Une autre complication du reflux est l’œsophage de Barrett qui se définit par la présence de métaplasie glandulaire de type intestinale dans l’oesophage.
La métaplasie intestinale se caractérise par la présence de cellules caliciformes. D’autres types de métaplasie glandulaire peuvent exister de type jonctionnel ou gastrique. L’ascension de la métaplasie glandulaire est circonférentielle ou irrégulière en flammèches. Parfois la zone en métaplasie englobe des ilôts malpighiens isolés (fig. 9).
L’importance clinique de cette métaplasie intestinale réside dans son potentiel malin : 20% des patients développent des adénocarcinomes.

Fig. 9 : Œsophage
de Barrett.
2. Pathogénie
On admet actuellement que l’œsophagite de reflux résulte d’un déséquilibre entre des forces agressives (reflux) et des forces défensives (clairance œsophagienne, résistance muqueuse).
a. Anomalies anatomiques (hernie hiatale)
La relation entre le reflux gastro-oesophagien et la
hernie hiatale par glissement est l’objet de controverses. Une hernie hiatale
s’observe dans 84% des cas d’œsophagite de reflux alors qu’à l’inverse une
œsophagite ne complique que 50% des
hernies hiatales par glissement. La hernie hiatale est probablement l’un des
facteurs intervenant dans la genèse de l’œsophagite de reflux, mais il n’est
certainement pas le seul.
b.
Forces agressives
L’acide chlorhydrique et la
pepsine sont les agents généralement responsables des lésions. On peut
occasionnellement observer des œsophagites de reflux chez les malades sécrétant
peu ou pas d’acide. On attribue ces lésions à un reflux de sécrétions
bilio-pancréatiques (reflux alcalin).
Un reflux pathologique est la
conséquence d’une anomalie de
fonctionnement du sphincter œsophagien inférieur. Deux facteurs
interviennent :
-
Un rythme élevé de relaxations inappropriées du sphincter œsophagien
survenant en dehors de la déglutition.
-
Une pression basale diminuée de ce sphincter.
c. Forces défensives
La clearance œsophagienne.
Chez le sujet normal, la vidange de œsophage (clairance œsophagienne) se fait
en deux temps. La première étape comporte une vidange du contenu œsophagien par
gravité ou par une ou deux ondes péristaltiques. La deuxième étape correspond
au retour du pH à la normale, notamment à la suite de l’action de la salive. En
présence d’une œsophagite de reflux, le temps de clairance est prolongé dans
environ 50% des cas. Comme la salive jour un rôle dans la neutralisation de
l’acide chlorhydrique, le tabagisme et les anticholinergiques favorisent
l’apparition des lésions œsophagite.
La résistance de la muqueuse.
Les processus de cytoprotection ont été principalement étudiés en pathologie
gastrique. Les notions concernant la « barrière muqueuse » de
œsophage sont moins connues. Celle-ci comporte notamment la présence d’une fine
couche de mucus provenant des glandes sous-muqueuses. Une barrière
hydrophobique sous la forme d’une couche phospholipidique représenterait une
barrière physique complémentaire. Le rôle protecteur de médiateurs endogènes
(métabolites de l’acide arachidonique) est l’objet d’investigations non
concluantes.
3. Manifestations cliniques
Œsophagite de reflux est fréquente (Prévalence 2 à 5%) mais bénigne.
La manifestation clinique la plus caractéristique est le pyrosis favorisé par les positions susceptibles de provoquer du reflux (décubitus dorsal, flexion du tronc). Il peut être aggravé par l’ingestion de repas copieux, de café, de chocolat, de boissons alcooliques. Il peut être accompagné de régurgitations.
La manifestation clinique la plus fréquente est une douleur épigastrique non irradiée.
La dysphagie apparaît généralement tardivement à la suite soit de troubles moteurs, soit de la formation de sténoses. Dans le premier cas elle est transitoire, alors que dans les sténoses, elle s’aggrave progressivement et commence par les aliments solides. La dysphagie peut être provoquée par le développement d’un cancer survenant dans le cadre d’une métaplasie intestinale (œsophage de Barrett).
Des symptômes atypiques peuvent se rencontrer : il s’agit soit de douleurs précordiales simulant une origine coronarienne, soit de manifestations pharyngées simulant un « mal de gorge », voire de raucité de la voix. Des épisodes de dyspnée nocturne confondue avec de l’asthme ont été décrits mais sont rares chez l’adulte.
Les hémorragies massives et les anémies ferriprives sont rares et s’observent chez les malades développant des ulcères profonds sur une muqueuse métaplasiée (ulcères de Barrett).
4. Diagnostic
Une endoscopie en vue de préciser la sévérité des lésions doit être pratiquée en cas de symptômes suggérant un reflux : chez les patients de plus de 45 ans, en cas de symptômes d’alarme (dysphagie, anémie, perte de poids), après un premier traitement empirique (alginates, anti-H2, IPP, prokinétiques) d’un mois inefficace ou suivi de récidive des symptômes.
On distingue :
- l’absence de lésions (reflux gastro-oesophagien avec endoscopie négative)
- l’oesophagite non compliquée : érythème, érosions
- l’oesophagite compliquée : ulcères profonds, sténose par fibrose, oesophage de Barett. Seule cette dernière entité nécessite un suivi endoscopique.
Dans un certain nombre de
cas, le diagnostic reste douteux. Il s’agit généralement de malades présentant
des symptômes atypiques (douleurs au lieu de pyrosis) souvent évocateurs d’une
maladie coronarienne. Dans ces cas, il convient de recourir à la mesure de pH œsophagien. La sensibilité
de la méthode est de +/- 90%
Une manométrie sera réalisée chez tous les malades proposés à une
intervention chirurgicale. Elle a pour but essentiel de dépister des anomalies
de la motricité œsophagienne qui contre-indique certaines techniques
chirurgicales.
La radiographie par repas baryté est indiquée en vue d’apprécier
l’importance d’une sténose et le résultat de son traitement par dilatations,
et, en préopératoire, de visualiser le type de hernie hiatale et de rechercher
un œsophage court.
L’endoscopie et la pHmétrie
peuvent être normales chez quelques malades présentant une symptomatologie
typique de reflux gastro-oesophagien. On explique cette symptomatologie par une
hypersensibilité de œsophage à l’acide (œsophage acido sensible).
5. Traitement
|
PRINCIPES DU TRAITEMENT
DU REFLUX GASTRO-OESOPHAGIEN |
|
|
1 TRAIT. EMPIRIQUE
SANS ENDOSCOPIE
|
|
|
·
SYMPTOMES TYPIQUES, ESPACES : - Règles hygiéno-diététiques, alginates ·
SYMPTOMES TYPIQUES, RAPPROCHES : Si âge < 45 ans et absence de signes
d’alarme - IPP 4 semaines ou anti-H2 8 semaines ou
prokinétiques 8 semaines |
|
|
2 TRAIT. APRES ENDOSCOPIE |
|
|
OESOPHAGITE ABSENTE OU
NON COMPLIQUEE a) Traitement d’attaque : - Précautions hygiéno-diététiques -
IPP ou anti-H2 ou prokinétiques b) Traitement d’entretien : non systématique. Si nécessaire : IPP (demi- ou pleine dose) ou chirurgie anti-reflux. |
OESOPHAGITE COMPLIQUEE a) Traitement d’attaque : - Sténose : dilatation endoscopique + IPP ou myotomie et chirurgie anti-reflux - Barret : IPP ou chirurgie anti-reflux - Ulcères profonds : IPP - Hémorragie : IPP b) Traitement d’entretien : IPP (pleine dose) ou chirurgie anti-reflux c) Suivi endoscopique. |
Les principaux buts à atteindre sont :
(1) de diminuer le reflux gastro-oesophagien ;
(2) d’accélérer la clairance œsophagienne ;
(3) de diminuer l’agressivité du liquide qui reflue.
Précautions hygiéno-diététiques
Elles sont utiles mais astreignantes et comportent :
- la surélévation de la tête du lit par des cales sous les pieds de la tête du lit ;
- la réduction de l’obésité (reflux et obésité sont traités dans le chapitre de l’obésité morbide) ;
- les graisses, le chocolat, le café, la menthe, le tabac doivent être évités car ils diminuent la pression du sphincter œsophagien inférieur.
Médicaments
Les médicaments de première ligne sont à base d’alginates (Gavisconâ). Ils forment un gel visqueux et protègent la muqueuse œsophagienne lors du reflux.
Les médicaments de deuxième ligne (prokinétiques et anti-sécrétoires acides) sont :
Les prokinétiques (cisapride : Prepulsidâ), les antagonistes H2 (ranitidine : Zantacâ) et les IPP (omeprazole : Losecâ, Logastricâ ; lansoprazole : Dakarâ ; pantoprazole : Pantozolâ, Zurcalâ).
Le choix du traitement médicamenteux dépend de l’intensité et de la fréquence des symptômes et de la présence ou non d’une oesophagite compliquée à l’endoscopie.
La proportion de patients dont les symptômes sont améliorés est la plus grande avec les IPP.
Le traitement est limité à un mois en cas d’oesophagite non compliquée.
Chez bon nombre de malades, la poursuite à long terme des mesures hygiéno-diététiques décrites plus haut évite les récidives.
Si de telles récidives surviennent, on peut soit administrer des IPP à long terme soit proposer une cure chirurgicale anti-reflux.
Traitement chirurgical
®
Indications
Le traitement chirurgical est indiqué dans les cas suivants :
- Sujets jeunes porteurs d’une œsophagite sévère et dépendant des IPP
- Reflux acide confirmé par une pHmétrie, non contrôlée par les IPP
- Reflux biliaire
- Régurgitations (liée à hernie hiatale ou hernie cardiale importantes)
®
Bilan préopératoire
Le bilan préopératoire comportera toujours :
- une endoscopie
- une manométrie œsophagienne pour orienter le choix de la technique : Nissen si la manométrie est normale, Toupet en cas de troubles de la motilité oesophagienne.
- un transit oesogastroduodénal pour localiser la jonction oesogastrique par rapport au diaphragme, pour estimer la longueur de œsophage (voie d’abord thoracique si œsophage court) et préciser le type d’hernie hiatale.
® Techniques
· L’opération de NISSEN (figure 10)
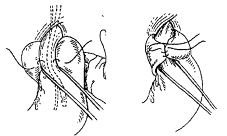 Après dissection par voie abdominale, du cardia, des piliers et
réduction éventuelle de la ligne Z en intra-abdominal, les vaisseaux courts
sont ligaturés et la poche-à-air est manchonnée autour de œsophage abdominal.
La valve de 360° ainsi créée s’oppose au reflux. Cette intervention est
réalisée par coelio-scopie et exceptionnellement par thoracotonie (si oesophage
court)
Après dissection par voie abdominale, du cardia, des piliers et
réduction éventuelle de la ligne Z en intra-abdominal, les vaisseaux courts
sont ligaturés et la poche-à-air est manchonnée autour de œsophage abdominal.
La valve de 360° ainsi créée s’oppose au reflux. Cette intervention est
réalisée par coelio-scopie et exceptionnellement par thoracotonie (si oesophage
court)

Fig. 10 : Opération
de Nissen
· L’opération de TOUPET (figure 11)

La partie haute de la poche à air est passée derrière
l’œsophage et fixée au pilier droit du diaphragme (hémivalve postérieure). Les
bords gauche et droit de la valve sont ensuite fixés sur l’œsophage. La valve
est de 270°.
Fig. 11 : Opération de Toupet
® Surveillance postopératoire
Une certaine dysphagie (témoin de l’efficacité de la valve et normalement transitoire) est attendue ; il faut aussi proscrire les boissons trop gazeuses , surtout après Nissen.
Si l’abord chirurgical est coélioscopique, le patient regagne précocément son
domicile. Le médecin traitant doit savoir :
1) que la première semaine peut être marquée par une complication opératoire rare mais grave (fistule oesopleurale),
2) que la réalimentation est progressive.
3) que le reflux gastro-oesophagien doit disparaître immédiatement après une chirurgie réussie
4) que le « gaz bloating » syndrome est la complication fonctionnelle la plus classique.
En cas d’œsophagite
compliquée :
® Sténose :
- Dilatations endoscopiques associées aux IPP
- Voire une solution chirurgicale si le patient est opérable : myotomie selon Heller que l’on complète par une valve de type Thal (la face séreuse de la valve ferme l’orifice créé par la section longitudinale).
® Barret
- IPP à haute dose (vu le reflux acide important) et surveillance endoscopique et biopsies à la recherche de dysplasie sévère dont la présence implique une oesophagectomie telle que réalisée pour traiter les cancers œsophagiens.
- Voire une chirurgie anti-reflux.
® Ulcères profonds et Hémorragies
- IPP
Un traitement par IPP à long terme est le plus souvent nécessaire . Il s’agit souvent d’une indication chirurgicale. Une surveillance est nécessaire.
III. LES TUMEURS
A. TUMEURS BENIGNES
1. Anatomopathologie
Les tumeurs bénignes de œsophage peuvent être épithéliales (papilloms épidermoïdes) ou mésenchymateuses. Les léiomyomes et les fibrolipomes constituent les variétés les plus fréquentes. Elles siègent de préférence au niveau du bas œsophage. On peut rencontrer des lipomes, angiomes et neurofibromes ainsi que des myoblastomes (témoins d’Abrizossof).
2. Manifestations cliniques et diagnostic
Les tumeurs bénignes sont
généralement asymptomatiques et sont souvent découvertes par hasard.
Lorsqu’elles atteingent un volume important, elles entraînent de la dysphagie.
Le diagnostic repose
principalement sur l’endoscopie avec prise de biopsies. L’examen baryté montre
une image lacunaire à contours réguliers sans altérations de la muqueuse de
voisinage. Cette masse est mobile et bombe dans la lumière œsophagienne.
3. Traitement
L’excision de la tumeur est le traitement de choix. Elle est pratiquée, non seulement pour supprimer une éventuelle dysphagie, mais surtout pour écarter tout risque de dégénérescence maligne. Les tumeurs de petite taille et asymptomatiques ne doivent pas être réséquées mais une surveillance s’impose.
B. TUMEURS MALIGNES
1. Fréquence et épidémiologie
Les cancers de œsophage sont assez rares (2,5% de tous les cancers) mais leur fréquence semble en augmentation. Ils surviennent plutôt chez l’homme que chez la femme (4/1) et surtout après 60 ans (75%). En Europe et aux USA, l’alcool et le tabac, surtout s’ils sont combinés, sont des facteurs favorisants. Dans les pays où la consommation d’alcool est réduite (Chine, Iran), l’ingestion de boissons chaudes pourrait jouer un rôle. La présence d’un agent infectieux (papillomavirus), d’un œsophage de Barrett, d’achalasie et de sténoses caustiques et radiques favorisent également le développement de cancers.
2. Anatomopathologie
La majorité (> 70%) des cancers de l’œsophage
sont des carcinomes épidermoïdes. Des adénocarcinomes sont également observés,
plus volontiers au niveau de l’œsophage distal. Ils se développent (30%) à
partir d’une muqueuse de Barrett ou bien témoignent de l’envahissement de
l’œsophage par un néoplasme gastrique. Les sarcomes sont exceptionnels.
a. Le
carcinome épidermoïde
D’un point de vue macroscopique, les carcinomes
épidermoïdes peuvent prendre des aspects polyploïdes, ulcéro-végétants ou
infiltrants. D’un point de vue microscopique, on distingue des formes bien,
moyennement ou peu différenciées en fonction de la plus ou moins bonne
expression des caractères de maturation : globes cornés, cellules
dyskératosiques, ponts intercellulaires.
Le cancer épidermoïde superficiel et le cancer
épidermoïde in situ représentent des stades précoces de la cancérisation. Leur
dépistage est rare en pratique clinique mais leur pronostic est excellent.
Sur les pièces de résection pour carcinome
épidermoïde, on observe fréquemment, dans le voisinage immédiat de la tumeur et
éventuellement à distance de celle-ci des foyers de carcinome in situ et de
dysplasie de grades divers. La multifocalité fréquente des lésions néoplasiques
n’intéresse pas seulement l’organe lui-même s’étend à la sphère ORL et aux
voies aériennes supérieures. Près de 20% des cancers épidermoïdes de l’œsophage
sont précédés, accompagnés ou suivis de cancers de ces organes.
Le carcinome épidermoïde s’étend dans la paroi de
l’œsophage, au-dessus et en-dessous de son origine, sur de longues distances,
notamment par les lymphatiques sous-muqueux. Au moment du diagnostic, une
partie importante de l’œsophage est en général atteinte. Les examens
endoscopiques et radiologiques sous-estiment cette extension intramurale. Les
marges de résection doivent être soigneusement étudiées, même lorsqu’elles sont
situées loin de la tumeur. Le contact étroit avec les viscères voisins explique
que la trachée et les bronches sont envahies chez certains malades. Le contact
étroit avec les viscères voisins explique que la trachée et les bronches sont
envahies chez certains malades. Des métastases ganglionnaires se développent
rapidement au niveau des ganglions médiastinaux, des ganglions
sus-claviculaires et des ganglions de la chaîne coronaire stomachique. Cette
extension rapide s’explique par la richesse lymphatique. La dissémination par
voie sanguine est plus tardive, mais la présence de métastases hépatiques et/ou
osseuses au moment du diagnostic n’est pas exceptionnelle. Elle atteint 80% des
cas autopsiés.
Le carcinome à cellules fusiformes, encore appelé
pseudo-sarcome, ou carcinome pseudo-sarcomateux est une forme rare. Il se
présente habituellement en macroscopie sous forme polypoïde. Cette tumeur
comporte une large proportion de cellules fusiformes d’allure sarcomateuse.
Cependant l’étude ultra-structurale met en évidence des tonofibrilles et des
desmosomes tandis que les méthodes immuno-cytochimiques démontrent la présence
de kératine. Le carcinome verruqueux est rare dans l’œsophage, mais est plus
fréquent dans d’autres sites (cavité bucco-pharyngée, organes génitaux). Il forme
des masses tumorales végétantes, exophytiques, à large base d’implantation et
souvent très étendues. L’excavation de formations cornifiantes détermine
l’apparition de pseudo-diverticules intramuraux. Histologiquement, les
bourgeons épithéliaux ont une limite nette, la formation de kératine est
abondante, les critères cytologiques de malignité sont peu marqués. Le
carcinome anaplasique à petites cellules, exceptionnel, est en tout point
semblable au carcinome anaplasique du poumon et manifeste comme ce dernier un
comportement agressif.
b. L’adénocarcinome
Macroscopiquement, comme histologiquement, les
adénocarcinomes ressemblent aux tumeurs gastriques analogues. La forme diffuse
(limite plastique) est rare.
Le carcinome adénoïde kystique et le carcinome muco-épidermoïde
sont rares et analogues à ceux observés dans les glandes salivaires.
c. Classification
TNM
Les paramètres intervenant dans les indications
thérapeutiques et dans l’établissement du pronostic d’une tumeur maligne sont
le degré d’extension locale, l’atteinte ganglionnaire et les métastases à
distance. Plusieurs classifications ont été proposées. La plus couramment
utilisée est la classification TNM de l’union internationale contre le cancer
(U.I.C.C.).
Par convention, le résultat du bilan préopératoire
s’exprime en termes T (Extension en profondeur de la tumeur), N (Nodes =
ganglions envahis), M (Métastases à distance) affectés d’un chiffre. S’il n’es
pas possible d’établir la présence de ganglions envahis, on affecte la valeur
« x » à N. Lors d’un bilan postopératoire réalisé par le pathologiste
à partir de la pièce d’exérèse, les lettres sont précédées d’un p (pathologie).

Pour l’œsophage, la
classification s’établit comme suit (voir figure 12).
Fig. 12 : classification TNM
|
· T1 Tumeur envahissant la
lamina propria ou la sous-muqueuse · T2 Tumeur envahissant le
muscle propre · T3 Tumeur envahissant
l’adventice · T4 Tumeur envahissant les
structures adjacentes · N0 Pas de métastases
ganglionnaires régionales · M0 Pas de métastases à
distance · M1 Métastases à distance |
N.B. : La classification TNM
s’applique au reste du tube digestif. Elle ne diffère de celle de l’œsophage
qu’au niveau de la définition de T3 et T4 et de N. On distingue N1, N2 dans
l’estomac, N1, N2, N3 dans le côlon et le rectum.
3. Manifestations
cliniques
La dysphagie est le symptôme le plus précoce et le plus constant. Dans
les cas caractéristiques, elle est constante
et progressive pour les solides puis pour les liquides. Le cancer de
l’œsophage à son début, ne provoque pas toujours une dysphagie caractéristique.
Il n’est pas rare d’observer des dysphagies capricieuses rappelant celle des
troubles fonctionnels. Toute dysphagie même occasionnelle et peu importante,
doit donc être explorée par endoscopie et radiologie. A un stade plus tardif,
surviennent de l’hypersalivation, des
régurgitations, de la dénutrition, des douleurs thoraciques, de la toux, de la
raucité de la voix. Ces derniers symptômes sont le témoin de l’extension
loco-régionale de la tumeur.
La principale complication
du cancer de l’œsophage est l’infection pulmonaire. Celle-ci résulte de
l’inhalation d’aliments ou de liquide digestif soit par régurgitation, soit par
fistule oesobronchique. Les hémorragies sont rares. Elles peuvent être massives
et mortelles par extension de la tumeur à l’aorte.
4. Diagnostic
Le diagnostic sera posé par endoscopie et biopsies, complétée par un
transit oesogastrique.
Ils révéleront les signes
classiques des tumeurs du tube digestif (lacune, sténose et rigidité,
destruction des plis, ulcérations à bords irréguliers). L’écho-endoscopie permet d’évaluer l’extension tumorale (staging
T1-T4) avec une précision de ± 90%, pour autant que la
tumeur soit franchissable. La radiographie
du thorax, la bronchoscopie et la tomodensitométrie permettent de réaliser
un bilan d’extension. L’extension à distance sera recherchée par échographie hépatique et scintigraphie
osseuse.
5. Bilan
préthérapeutique
|
BILAN PRETHERAPEUTIQUE DU CANCER OESOPHAGIEN OPERABILITE ? Terrain
respiratoire Terrain hépatique Terrain cardio-vasculaire 40% d’exclusTerrain
nutritionnel CURABILITE ? Métastases :
hépatiques, cœliaques, sus-claviculaires RESECABILITE ? Scanner Echoendoscopie Si la réponse est oui à
ces trois questions, le traitement sera chirurgical (± 45% des cas). |
Le patient est-il opérable ?
Il faut évaluer le terrain
respiratoire (Rx poumons, épreuves fonctionnelles respiratoires),
cardio-vasculaire, hépatique (cirrhose associée) et nutritionnelle.
L’affection est-elle curable
?
Il faut exclure des
métastases à distance (hépatiques, cœliaques ou sus-claviculaires).
La tumeur est-elle résécable
?
Les tumeurs T4
diagnostiquées par l’échoendoscopie et le scanner thoracique ne sont pas
résécables.
6. Traitement
a. A visée curative
Une chirurgie de résection
doit être envisagée pour des tumeurs localement peu étendues (T1, T2 et
certains T3) survenant chez des malades aptes à supporter une chirurgie
majeure. Une préparation minutieuse par nutrition parentérale et kinésithérapie
respiratoire est souhaitable.
Une résection large, préférentiellement subtotale de l’œsophage sera
réalisée. L’oesophagectomie pour cancer doit respecter certaines règles :
· résection
« en bloc » de l’oesophage et de la partie supérieure de l’estomac ;
· curage des pédicules gastro-duodénaux coronaires, loco-aortiques et résection de la crosse de l’azygos ;
· respect
des 10 cm proximaux de sécurité et examen extemporané avant anastomose.
Le transit digestif sera
rétabli par transposition soit de l’estomac, soit du côlon, suivant des
techniques précédemment décrites.
Les adénocarcinomes
localisés au cardia et
résécables, seront traités, soit par une oeso-gastrectomie
totale avec anastomose oeso-jéjunale en Y, soit par une oeso-gastrectomie
partielle avec anastomose de l’œsophage moyen à la partie distale de l’estomac.
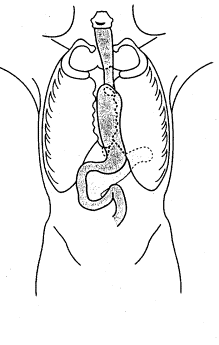
Fig.13 : Reconstitution oesophagienne par gastroplastie après
oesophagectomie.
En cas de tumeurs extensives (les T3, T2, N1) une chimio-thérapie périopératoire
est associée à la chirurgie. Les indications précises restent cependant l’objet
de controverses.
b. A visée palliative
Le but du traitement
palliatif est de supprimer la dysphagie et d’éviter les complications
pulmonaires. Il sera envisagé chez les malades non opérables pour des raisons
générales ou locales (T4 ou M1).
Plusieurs alternatives sont
possibles. Elles peuvent éventuellement être associées entre elles.
·
La
mise en place par voie endoscopique ou plus rarement chirurgicale d’une
prothèse endo-oesophagienne. Cette prothèse introduite à frottement dur à
travers la tumeur permet au malade de se nourrir, évite la stase alimentaire et
salivaire et obture les fistules oeso-bronchiques.
·
La
destruction partielle de la tumeur par laser ou électrocoagulation bipolaire.
·
La
radiothérapie et/ou la chimiothérapie.
7. Pronostic
Le pronostic global du
cancer de l’œsophage reste très défavorable car la majorité des malades se
présentent à un stade avancé de la maladie. La survie à 5 ans des patients
opérés est de 25% en moyenne, tous stades confondus.
IV. LES TRAUMATISMES
1. Les corps étrangers
déglutis
Des malades mentaux et
accidentellement des adultes, déglutissent parfois un corps étranger. Si
celui-ci est peu volumineux et ne présente ni aspérités tranchantes ni crochets,
il passera facilement dans l’estomac. Dans le cas contraire, il sera arrêté en
général à l’un des rétrécissements de l’œsophage : sphincter crico-pharyngé,
aorte, cardia. S’il n’est pas extrait à temps, il risque de provoquer une
obstruction, une œsophagite et même une médiastinite par perforation.
Le diagnostic sera suspecté à
partir des plaintes de dysphagie, d’odynophagie et de sensation persistante de
corps étranger. Il sera confirmé par la visualisation endoscopique et/ou
radiologique du corps étranger dans l’œsophage. Lorsque le corps étranger est
radio-transparent, la radiographie, après ingestion de gastrografine, peut
montrer sa présence. Lors de cet examen, il faut prendre toutes dispositions
pour éviter que le patient inhale le produit de contraste.
Le corps étranger, s’il n’est
pas passé spontanément dans l’estomac, sera extrait par voie endoscopique ou
après fragmentation. Si son extraction est impossible, on tentera de le pousser
dans l’estomac. Une fois dans l’estomac, il s’éliminera en général par les
voies naturelles.
2. Les perforations
La perforation de l’œsophage
peut résulter de l’ingestion de caustiques, de la déglutition d’un corps
étranger ou de manœuvres endoscopiques. Elle peut se produire spontanément lors
de vomissements importants (syndrome de Boerhaave). Dans ce dernier cas, elle
survient dans le tiers inférieur de l’œsophage et à gauche.
Les sécrétions digestives et
le contenu de l’œsophage se répandent dans le médiastin et entraînent le
développement d’une médiastinite caractérisée par de la tachycardie, de la
fièvre et une altération rapide de l’état général. L’infection s’étend à la
plèvre gauche et y provoque une pleurésie purulente. La plèvre droite est plus
rarement atteinte. Enfin, la perforation de l’œsophage est occasionnellement
responsable d’un pneumomédiastin avec emphysème sous-cutané, décelable par la
palpation sus-sternale et visible à la radiographie.
V. DIVERS
1. Le syndrome de
Mallory-Weiss
Le syndrome de Mallory-Weiss
est une déchirure longitudinale de la muqueuse œsophagienne au niveau du
cardia. Cette déchirure apparaît habituellement après des efforts de
vomissements. L’éthylisme aigu est un facteur favorisant. Ce syndrome est
responsable d’environ 10% des hématémèses. Le diagnostic de syndrome de
Mallory-Weiss doit être évoqué chez un malade qui, après l’ingestion de
boissons alcooliques, présente des vomissements répétés d’abord de liquide
digestif puis de sang rouge. L’endoscopie permet le diagnostic. L’évolution est
en général spontanément favorable. La suture chirurgicale de la lésion ne sera
pratiquée que dans des cas exceptionnels de persistance de l’hémorragie.
2. Les diverticules
Les diverticules de
l’œsophage sont des hernies de la muqueuse à travers les couches musculeuses.
On distingue, selon la
localisation, trois types de diverticules œsophagiens :
·
les
diverticules pharyngo-oesophagiens, de pulsion (diverticules de ZENKER)
·
les
diverticules thoraciques, de traction
·
les
diverticules épiphréniques où les deux mécanismes, traction et pulsion, sont
associés.
Les diverticules de ZENKER
sont les plus connus par la clinique.
Situés à la jonction
pharyngo-oesophagienne, les diverticules de Zenker se développent à partir de
la paroi postérieure de l’œsophage entre les fibres cricopharyngées du
constricteur inférieur de l’œsophage. Ils résultent d’une faiblesse musculaire
de la paroi postérieure de l’œsophage associée à une incoordination mineure des
ondes de contraction primaires. La paroi postérieure de l’œsophage est donc
refoulée vers l’arrière puis vers la gauche lorsque le diverticule glisse sur
l’aorte.
Cette affection est observée
trois fois plus souvent chez l’homme que chez la femme : le larynx masculin est
plus développé et la paroi postérieure de l’œsophage plus faible.
Au début, la maladie est
quasi-asymptomatique et seule une impression d’irritation, de présence de corps
étranger dans la gorge est ressentie. La dysphagie apparaît plus tard. Elle
survient, en général, à la fin des repas (lorsque le diverticule est rempli
d’aliments). Une haleine fétide et de la régurgitation peuvent survenir.
Celle-ci peut provoquer l’apparition d’une toux nocturne. Une obstruction
complète de l’œsophage peut s’installer après une longue évolution. Des
symptômes pulmonaires par régurgitation et inhalation d’aliments sont occasionnellement observés (infection et abcès).
Le diagnostic du diverticule de Zenker est posé par les examens usuels en
pathologie œsophagienne (endoscopie et radiologie).
Un traitement endoscopique
des diverticules de Zenker a été développé. Il consiste en une section au laser
du septum séparant le diverticule de l’œsophage. Quelques indications
chirurgicales subsistent. L’intervention la plus courante est la résection du
diverticule. D’aucun ont proposé d’associer à la résection une myotomie du
cricopharyngé. Selon les centres, le diagnostic est réalisé par le
gastro-entérologue, le médecin ORL ou le chirurgien digestif.
3. Les anneaux œsophagiens
Parmi les anneaux de
l’œsophage inférieur, on distingue deux types de structure : le premier (anneau
de Schatzki) est situé à la jonction gastro-oesophagienne. C’est un
épaississement fibreux de la sous-muqueuse. Il est responsable de dysphagies
intermittentes et de durée variable (quelques minutes à quelques heures) ou
d’une dysphagie brutale et totale par impaction d’un morceau de viande ou de
pain. Plus rare est l’anneau musculaire dont le siège est voisin de celui de
Schatzki. Manométriquement, il correspond à une zone de haute pression. Il est
associé à des troubles moteurs œsophagiens.
Le traitement est médical et
comporte : la mastication soigneuse, le choix des aliments et le calme durant
les repas. En cas de sténose serrée, une dilatation par bougies peut se révéler
nécessaire.
4. Les maladies du
collagène
a. La Sclérodermie
La sclérodermie s’accompagne
parfois de lésions d’atrophie muqueuse et musculaire de l’œsophage responsables
de dysphagie. Des phénomènes d’œsophagite par incontinence sphinctérienne ont
également été décrits. Des rétrécissements peuvent provoquer une aggravation de
la dysphagie. Le traitement est symptomatique.
b. La Dermatomyosite
La dysphagie, dans ces cas,
est surtout en relation avec l’atteinte des muscles du pharynx. Le
péristaltisme œsophagien est également diminué.
5. Le syndrome de Cyriax,
le syndrome de Tietze et la Xyphoïdynie
Le syndrome de Cyriax est dû
à une irritation du 8ème, 9ème ou du 10ème nerf intercostal par
subluxation traumatique de l’articulation chondro-costale correspondante. Il
provoque des douleurs aiguës répétitives rappelant celles de l’infarctus du
myocarde, ou des douleurs sourdes, répétitives qui peuvent ressembler à celles
de l’ulcère gastro-duodénal, de la pancréatite aiguë ou de la colique biliaire.
A l’examen physique, on note principalement la présence d’un point douloureux
électif au niveau du rebord costal. Le diagnostic est clinique et les
infiltrations de xylocaïne sont efficaces.
Le syndrome de Tietze est une
inflammation douloureuse des articulations chondro-costales des côtes
supérieures ou des articulations sterno-claviculaires.
La xyphoïdynie est une
douleur au niveau de l’appendice xiphoïde.
I. MANIFESTATIONS
CLINIQUES
Les manifestations les plus
fréquentes des affections gastriques sont la douleur, la dyspepsie et
les vomissements.
Aucun de ces symptômes n’est
caractéristique des maladies gastriques comme la dysphagie l’était pour les
maladies œsophagiennes. De très nombreuses maladies abdominales provoquent des douleurs localisées à l’épigastre.
Cette zone représente, en effet, la zone de douleur reportée de nombreux
viscères abdominaux. Les caractéristiques de la douleur (brûlures, crampes,
etc.) n’ont qu’un intérêt diagnostique limité. Par contre, la périodicité dans
la journée et dans l’année peut constituer un élément important permettant
souvent d’orienter le diagnostic d’une manière assez précise. La dyspepsie est caractérisée par des
douleurs épigastriques peu intenses, une sensation de réplétion gastrique, des
éructations et du ballonnement. C’est l’une des causes les plus fréquentes de
consultation en gastro-entérologie. De très nombreuses maladies digestives
(œsophagiennes, gastriques, coliques, bilio-pancréatiques) peuvent provoquer de
la dyspepsie. Les vomissements
alimentaires ou bilieux peuvent avoir des origines très variées digestives ou
extra-digestives. Seuls les vomissements sanglants indiquent la présence
hautement probable d’une affection gastro-duodénale (ou œsophagienne).
La partie distale de
l’estomac est aisément accessible à l’examen physique. Celui-ci est donc
important pour le diagnostic de certaines affections gastriques (tumeurs,
sténoses pyloriques, etc.).
II. METHODES D’EXPLORATION
1. La fibroscopie
Il est unanimement admis que
la fibroscopie est le premier examen à réaliser en cas de suspicion d’affection
gastrique. Cet examen est en général complété par la prise de biopsies.
2. La radiologique
classique, la tomodensitométrie, l’échoendoscopie
Ces examens seront réalisés
dans deux circonstances principales :
·
Le
diagnostic des tumeurs malignes et des sténoses antéro-pyloriques
·
La
détermination du stade évolutif de ces tumeurs (envahissement de la paroi,
présence d’adénopathies).
3. La recherche de
l’Hélicobacter pylori
Les Helicobacters pylori
(H.p.) sont des organismes gram-négatifs spiralés à extrémités arrondies
mesurant 3 à 4 mm de long et 0.5 à 1 mm de large ; 3 à 5 flagelles sont
implantés à un des pôles. Le germe est aisément identifiable en culture par sa
propriété de métaboliser l’urée.
L’H.p. a comme seul
réservoir l’estomac humain. La contamination se fait par voie oro-orale ou
féco-orale. Le risque d’infection est plus élevé dans les populations à statut
socio-économique faible et/ou vivant dans des conditions d’hygiène précaire
(pays en voie de développement). La fréquence de l’infection augmente avec
l’âge. Le sexe et le mode de vie sont sans importance.
L’H.p. joue un rôle
important dans l’étiologie des maladies suivantes :
·
Certaines gastrites
atrophiques
·
La quasi totalité des
ulcères duodénaux et la plupart des ulcères gastriques
·
Certains lymphomes
gastriques (maltomes).
Le rôle de ce germe est moins important et plus
discuté dans les adéno-carcinomes et les lymphomes banaux.
Les méthodes suivantes sont disponibles pour
diagnostiquer sa présence :
(A) Méthodes invasives
réalisées sur des biopsies
1.
L’examen
anatomo-pathologique. Sur coupe en paraffine, il est déjà visible par des
colorations habituelles à l’hématoxyline éosine. La coloration de Giemsa
modifiée ou une coloration au violet de Crésyl sont plus favorables pour la
routine.
2.
La
culture du germe (qui permet la détermination de la sensibilité aux
antibiotiques)
3.
La
recherche de l’activité uréasique de H.p. par incubation de la biopsie dans un
milieu contenant un indicateur coloré réagissant au dégagement de NH3.
4.
Un
test d’amplification génique (PCR).
(B) Méthodes non invasives
1.
Un
test respiratoire isotopique basé sur la destruction d’urée C14 (ou
C13) ingérée avec un repas (mesure de C14 ou de C13
dans l’air expiré).
2.
Un
test sérologique (qui convient surtout au dépistage).
4. L’exploration
fonctionnelle de la sécrétion gastrique
Elle est rarement utilisée et s’indique pour la mise
au point d’ulcère réfractaire, la recherche de Zollinger-Ellison ou la mise au
point d’une hypergastrinémie.
Cette étude, en routine clinique, est limitée à la
seule sécrétion acide. Le suc gastrique est recueilli par la mise en place
d’une sonde dans l’estomac. La totalité
du suc gastrique doit être aspiré. Usuellement, on collecte des échantillons de
15 minutes. On procède sur chaque échantillon au titrage de l’acidité par
addition de NaOH jusqu’à pH 7.4.
Au départ du volume des échantillons siphonnés et
des concentrations correspondantes, on calcule le débit acide c’est-à-dire la quantité totale d’H+,
sécrétée dans un temps donné. Le débit est exprimé en mEq ou en mmol pour le
temps considéré.
a. Test
à la pentagastrine
On mesure le débit
acide basal (BAO ou Basal acide output = < 5 mmol/h) pendant 1 heure,
puis on injecte de la pentagastrine (6 µg/kg SC) et l’on mesure le débit
réactionnel pendant l’heure suivant l’injection. Ceci permet de calculer le pic acide horaire (qui correspond à la
somme des deux débits acides consécutifs les plus élevés multipliée par deux) =
PAO ou Peak acide output (Valeurs normales : PAO 10 - 50 mmol/h).
Le pic acide horaire est proportionnel à la masse de
cellules pariétales activables et permet donc d’estimer le degré d’atrophie de
la muqueuse en cas de gastrite atrophique.
b. Test
à la sécrétine
Le test comporte une mesure de la sécrétion basale
suivie d’une étude de la réaction à une injection IV de sécrétine (3 U/kg). En
dehors des gastrinomes, la sécrétine inhibe la sécrétion gastrique. Une
stimulation paradoxale, non expliquée, s’observe dans les syndromes de
Zollinger-Ellison.
Ce test n’est utile que pour diagnostiquer des
gastrinomes.
c. Dosage radio-immunologique de la gastrine sanguine
Le dosage de la gastrine dans le sang est réalisé en
routine. Le taux normal varie en fonction de l’immunsérum utilisé. Il est en
général < à 100 pg/ml.
Des hypergastrinémies massives (plus de 10 fois les
valeurs normales) sont observées dans deux conditions pathologiques : la
gastrinome et la gastrite atrophique auto-immune.
Des hypergastrinémies modérées sont observées dans
de nombreuses conditions : petit gastrinome, gastrite atrophique,
hyperréactivité des cellules G, traitement par des inhibiteurs de la pompe à
protons, insuffisance rénale. Chez la majorité des malades, le contexte
clinique et endoscopique indique l’origine de l’hypergastrinémie. Un doute peut
toutefois exister en cas de maladie ulcéreuse dont l’origine peut être soit un
gastrinome, soit une hyperréactivité des cellules G.
5. L’étude de la vidange gastrique
La scintigraphie évaluant la phase solide et liquide
est indiquée en cas de mise au point de suspicion de gastroparésie.
I. LES GASTRITES AIGUES
Les manifestations inflammatoires aiguës de
l’estomac peuvent revêtir des aspects lésionnels très variables en intensité.
Les formes bénignes (gastrites superficielles) ne comportent qu’une
infiltration de la muqueuse par des polynucléaires. Les formes graves sont
hémorragiques. On observe diverses lésions chez ces malades : purpura de la
muqueuse, érosions superficielles, ulcères non hémorragiques et ulcères
hémorragiques. Ces lésions sont presque toujours multiples et disséminées.
Elles représentent des stades différents d’une même maladie.
1. La gastrite superficielle
Elles sont en général la conséquence d’une
alimentation irritante par exemple la prise d’alcool. Elles évoluent
spontanément vers la guérison et ne nécessitent aucun traitement.
2. La gastrite hémorragique
Les causes les plus fréquentes de gastrite
hémorragique sont la prise de médicaments et le stress.
Les médicaments impliqués sont l’aspirine et les
anti-inflammatoires non stéroïdiens (AINS : phénylbutazone, indométacine,
etc.). Ces médicaments agissent à la fois par une action locale et par une
action systémique. Le rôle inhibiteur de ces médicaments sur la synthèse des
prostaglandines endogènes serait l’un des mécanismes physiopathologiques les
plus importants. La gastrotoxicité des corticoïdes reste controversée.
Des malades, habituellement hospitalisés dans des
unités de soins intensifs, pour des traumatismes graves (fractures multiples,
traumatismes crâniens, brûlures) ou des infections sévères, et présentant des
atteintes fonctionnelles pluri-organiques (insuffisance respiratoire, rénale,
hépatique) peuvent développer des gastrites
hémorragiques aiguës. Leur fréquence a diminué au fur et à mesure de
l’amélioration de la réanimation. Actuellement, 1 à 2% des malades exposés
présentent une hémorragie nécessitant des transfusions, le risque étant
cependant sensiblement plus élevé chez les brûlés et les traumatisés crâniens.
La manifestation clinique principale des gastrites
aiguës est l’hémorragie dont l’intensité est très variable. 30% des hémorragies
digestives hautes sont dues à des gastrites. Seule une endoscopie réalisée en
période hémorragique ou post-hémorragique permet le diagnostic.
Le traitement comporte la suppression de la cause,
l’administration d’antisécrétoires et, éventuellement, de transfusions
sanguines. Exceptionnellement,
on traitera des ulcères hémorragiques localisés par endoscopie ou par
chirurgie.
On admet généralement l’effet préventif de
l’administration de prostaglandines en cas de traitement par les
anti-inflammatoires. Pour certains auteurs, les gastrites de stress peuvent,
chez certains malades, être prévenues par l’administration d’antisécrétoires ou
de sucralfate.
II. LES GASTRITES CHRONIQUES
A. ANATOMIE
PATHOLOGIQUE
On regroupe sous le terme de gastrites chroniques
toutes les gastrites s’accompagnant d’un infiltrat
cellulaire important de la lamina propria qu’il soit superficiel ou étendu
à toute la hauteur de la muqueuse.
Quelle que soit leur étiologie, les gastrites
chroniques évoluent habituellement vers l’aggravation. Le réseau glandulaire
est progressivement détruit provoquant une atrophie
de la muqueuse. Cette dernière s’accompagne de phénomènes de métaplasie épithéliale : antropylorique
au niveau des glandes fundiques, et intestinale au niveau des cryptes et de
l’épithélium de surface.
1. Les gastrites chroniques
a. La
gastrite antrale ou diffuse
(1) Helicobacter positive
La gastrite à Helicobacter est la plus fréquente des
gastrites chroniques (plus de 90% des gastrites). Dans notre pays, 50% des
malades de plus de 50 ans sont porteurs de ce type de lésion.
La gastrite provoquée par Helicobacter prend son origine dans la région antrale.
Elle peut s’étendre, plus tard, au
fundus. Les lésions de gastrite dues à l’Helicobacter sont, dans un premier
temps, aiguës. Elles évoluent rapidement vers une gastrite chronique qui
s’accompagne de destructions glandulaires induisant une atrophie de la
muqueuse. L’épithélium altéré subit focalement une métaplasie intestinale.
L’Helicobacter pylori peut exceptionnellement se rencontrer dans l’estomac normal. On le trouve par contre fréquemment chez les malades atteints de gastrite chronique ou d’ulcère gastro-duodénal. Sa présence est associée à une inflammation de type aigu (polynucléaires) ainsi qu’à une réaction lymphoplasmocytaire du chorion. La bactérie se développe au contact direct des cellules, sous la couche de mucus protectrice. L’intégrité de cette dernière conditionne son développement et on ne rencontre jamais d’Helicobacter pylori dans les foyers de métaplasie intestinale ni dans les zones lésionnelles où l’épithélium de surface et des cryptes est indifférencié. Par contre, l’Helicobacter peut coloniser des foyers de muqueuse gastrique ectopiques (œsophage, duodénum). On le rencontre fréquemment dans les foyers de métaplasie gastrique du duodénum.
|
TABLEAU 1 : CLASSIFICATION DES GASTRITES CHRONIQUES |
|
|
Type de gastrite |
Localisation |
|
I. GASTRITES CHRONIQUES 1.
Gastrite chronique antrale ou diffuse Helicobacter positive Helicobacter négative 2.
Gastrite chronique auto-immune II. AUTRES GASRITES Gastrites chimiques Gastrite lymphocytaire Gastrites ganulomateuses Gastrites rares |
Antre s’étendant au fundus Fundus Antre et/ou fundus Fundus Antre |
Les mécanismes par lesquels l’Helicobacter pylori provoque le développement de gastrites impliquent d’une part la virulence du germe et d’autre part la réaction de l’hôte. L’Helicobacter pylori exercerait son rôle pathogène en induisant des lésions au niveau des cellules épithéliales superficielles et des jonctions intercellulaires.
Un traitement par antibiotiques éradiquant l’Helicobacter guérit la gastrite chronique. Les infiltrats à polynucléaires disparaissent en quelques semaines, mais les infiltrats lymphocytaires perdurent de 6 à 12 mois.
(2) Helicobacter négative
La gastrite à Helicobacter représente une large
majorité des gastrites chroniques à départ antral. Un certain nombre de cas ont
cependant une autre origine comme le gastrosporillium heilmanii ou les AINS.
Parfois leur origine est inconnue.
b. La
gastrite auto-immune
On sait depuis de nombreuses années que la maladie
de Biermer (anémie pernicieuse) se développe dans un contexte de gastrite
sévère, atrophiante. Cette atrophie s’accompagne d’une accélération du
renouvellement cellulaire et on observe de très nombreuses mitoses. Des études
finlandaises, basées sur l’analyse de biopsies itératives réalisées chez des
descendants de patients porteurs de la maladie, ont montré que cette gastrite
apparaissait avant la quarantaine, qu’elle s’aggravait progressivement et
évoluait inexorablement vers l’atrophie de la muqueuse gastrique.
Les altérations gastriques sont consécutives à la
production d’anticorps dirigés contre
les cellules pariétales du fundus. Il existe de rares exceptions à cette
règle et quelques patients peuvent développer une anémie pernicieuse sans
atteinte gastrique concomitante. On invoque dans ces cas le rôle d’une réaction
immune de type cellulaire.
La gastrite auto-immune se cantonne au fundus. Une atteinte antrale concomitante résulte de
la coexistence d’un autre type de gastrite (en général, liée à l’Helicobacter
pylori).
2. Autres formes de gastrites
a. Gastrite
chimique
On sait depuis longtemps que le reflux biliaire peut
provoquer une congestion de la muqueuse antrale et éventuellement fundique.
Après une gastrectomie, le moignon gastrique est soumis à un important reflux biliaire.
On observe dans les mois ou les années qui suivent l’intervention, des
modifications de la muqueuse qui aboutissent à l’atrophie de cette dernière.
Contrairement aux autres gastrites chroniques, la
gastrite de reflux biliaire montre peu d’infiltration cellulaire du chorion.
Celui-ci est le siège d’un œdème surtout superficiel et d’une prolifération et
d’une congestion vasculaire intense. L’architecture des cryptes se modifie.
Leur taille augmente tandis que leurs contours deviennent irréguliers, plissés.
Cette altération des cryptes exprime un renouvellement accru de l’épithélium.
La sécrétion du mucus est en général peu altérée.
Le même type de modification de la muqueuse peut se
rencontrer dans d’autres conditions que le reflux biliaire telles que la prise
répétée d’anti-inflammatoires ou la consommation exagérée d’irritants
gastriques. On a proposé de donner à cette gastrite le nom de gastrite de type
chimique ou de gastrite réactionnelle plutôt que de gastrite de reflux
biliaire.
b. La
gastrite lymphocytaire
Une infiltration massive de l’épithélium de surface
et des cryptes par de nombreux lymphocytes caractérise cette entité
histologique. Le diagnostic des gastrites lymphocytaires repose sur une
numération des lymphocytes intraépithéliaux (supérieure à trente par cent
cellules épithéliales superficielles). D’après les données de la littérature,
cette valeur laisse une large marge de sécurité par rapport aux autres types de
gastrites. La fréquence de l’affection dans une série de biopsies gastriques
est de ± 2%.
c. Les
gastrites granulomateuses
La plus importante est la maladie de Crohn. Dans 50%
des localisations gastriques, l’histologie a permis de détecter des granulomes.
On décrit également une gastrite tuberculeuse et une atteinte de type
parasitaire (anisakiase) ainsi qu’une gastrite granulomateuse aspécifique.
d. Les
gastrites chroniques rares
On range dans cette catégorie de gastrites un
certain nombre d’affections dont la présentation clinique et endoscopique est
en général caractéristique (Maladie de Ménétrier, Gastrite hypertrophique
hypersécrétante du Syndrome de Zollinger-Ellison).
La maladie de Ménétrier est une gastrite chronique
hypertrophique. La muqueuse est épaissie par un allongement des tubes
glandulaires constitués principalement de cellules muqueuses. La partie
profonde des glandes présente des dilatations kystiques.
B. MANIFESTATIONS CLINIQUES ET DIAGNOSTIC
Le diagnostic de gastrite chronique repose
essentiellement sur les données apportées par des prélèvements biopsiques
obtenus par endoscopie. Il ne peut être posé sur les seules données cliniques
ou endoscopiques.
La gastrite
antrale ou diffuse quelle soit H.P. positive ou négative est le plus souvent totalement
asymptomatique. Chez certains malades, on observe un ou plusieurs des symptômes
suivants : nausées, vomissements, éructations, ballonnement, plénitude
postprandiale, douleurs abdominales imprécises, syndrome ulcéreux, pyrosis. Les
aspects endoscopiques sont très variables allant de l’absence de lésions à la
présence de lésions nodulaires ou érosives localisées préférentiellement à
l’antre. Il n’y a aucun lien démontré
entre les anomalies endoscopiques ou histologiques d’une part et l’existence de
symptômes ou l’importance de ces symptômes d’autre part.
La gastrite
auto-immune ne se manifeste par aucune symptomatologie digestive. Elle
s’accompagne à long terme d’une maladie de Biermer par carence en facteur
intrinsèque. D’autres maladies auto-immunes (thyroïdite, anémie hémolytique à
auto-anticorps) lui sont souvent associées. L’endoscopie montre une atrophie
complète de la muqueuse fundique (image en fond d’œil). Le diagnostic sera
confirmé par la recherche d’auto-anticorps (anticellules pariétales et
anti-facteur intrinsèque) ainsi que par la présence d’une hypergastrinémie
réactionnelle à l’achlorhydrie.
La gastrite
chimique peut entraîner des douleurs épigastriques (brûlures)
éventuellement aggravées par les repas. L’endoscopie montre principalement une
congestion de la muqueuse.
Le diagnostic de gastrite granulomateuse repose sur la présence simultanée de
lésions iléales et coliques et sur une image endoscopique ou radiologique
d’atteinte gastrique suggestive.
La gastrite
lymphocytaire se manifeste par un syndrome ulcéreux, de l’amaigrissement et
une hypoprotéinémie. Du point de vue endoscopique, on observe en général (dans
les 2/3 des cas) des gros plis érodés et des nodules prédominant dans le fundus
ou intéressant l’ensemble de la muqueuse gastrique. Cet aspect endoscopique est
appelé gastrite varioliforme. Le même type de modifications
endoscopiques localisées à l’antre (gastrite varioliforme antrale) aurait une
signification différente puisqu’elle n’est que rarement liée à l’afflux de
lymphocytes mais se rencontre dans des états variés : gastrites chroniques
Helicobacter positives, érosions localisées de caractère aigu. La maladie de
Crohn gastrique peut également donner des images endoscopiques rappelant celles
de la gastrite varioliforme.
La maladie de
Ménétrier prédomine dans le sexe mâle (80%). Longtemps latente, elle se
manifeste par des douleurs épigastriques et une hypoalbuminémie. L’endoscopie
est très évocatrice. Des biopsies profondes doivent être pratiquées pour
confirmer le diagnostic. L’évolution est dominée par le risque de cancérisation
qui atteint 10%.
C. TRAITEMENT
En l’absence de relations précises entre les lésions
et les manifestations cliniques, le traitement de la gastrite antrale ou diffuse ne peut être que symptomatique. Des
études de consensus ont montré que, d’une manière générale, il n’était pas
utile d’éradiquer l’H.P. lorsqu’il est présent. Les effets de cette éradication
sur la symptomatologie subjective sont très inconstants, l’atrophie et la
métaplasie ne régressent pas et l’effet préventif sur le développement de cancer
est quasiment inexistant. Le traitement de l’HP est par contre recommandé
lorsque la gastrite s’accompagne d’ulcères gastriques ou duodénaux.
Il n’y a pas de thérapeutique spécifique de la gastrite atrophique auto-immune. On se
limitera donc au traitement de l’anémie qui est la conséquence de
l’achlorhydrie et de la disparition du facteur intrinsèque (administration de
fer et de vitamine B12).
Pour les gastrites
de reflux biliaire, les gels à base d’alumine et de magnésium peuvent être
utiles car ces gels lient les sels biliaires. La cholestyramine, théoriquement
logique, semble, en pratique, peu efficace.
La gastrite
lymphocytaire a été traitée avec succès par les inhibiteurs de la pompe à
proton.
Il convient de surveiller endoscopiquement les
malades atteints de gastrite chronique avec atrophie muqueuse et métaplasie
intestinale à cause du développement
fréquent de polypes et de cancers (3 fois plus que dans une population
normale). La gastrite auto-immune prédispose au développement de tumeurs carcinoïdes
gastriques. Ces tumeurs sont dues à l’hypergastrinémie présente chez ces
malades.
CHAPITRE III :
L’ULCERE GASTRO-DUODENAL
L’ulcère gastro-duodénal ou maladie ulcéreuse se
caractérise par la formation d’ulcérations uniques ou multiples dans l’estomac
ou le bulbe duodénal.
La maladie est chronique et récidivante évoluant par
périodes d’activité (récidives) suivies de rémissions.
I. EPIDEMIOLOGIE
Dans les pays occidentaux, la prévalence de l’ulcère
gastro-duodénal est variable en fonction du type d’ulcère (2% pour l’ulcère gastrique, 10% pour l’ulcère
duodénal), la présence (10 à 20% de prévalence d’ulcère) ou l’absence (5 à 10%)
d’Helicobacter pylori, du sexe (en diminution chez l’homme et en
augmentation chez la femme) et de l’âge
(en diminution chez l’homme jeune et en augmentation chez la femme âgée).
II. ETIOLOGIE ET PHYSIOPATHOLOGIE
On admet que l’ulcère gastro-duodénal est dû à un
déséquilibre entre des facteurs agressifs et des facteurs de défense.
|
FACTEURS DE DEFENSE |
FACTEURS AGRESSIFS |
|
Bicarbonates (HCO-3) Mucus Facteurs de croissance Prostaglandines Renouvellement cellulaire |
H.pyloriAcidité (H+) Pepsine Tabac - Alcool - AINS - Aspirine Flux sanguin muqueux |
Facteurs
agressifs
- Acide (HCl)
La formule « pas
d’acide, pas d’ulcère » est toujours respectée. La sécrétion acide basale
et stimulée est normale ou diminuée en cas d’ulcère gastrique et est élevée en
cas d’ulcère duodénal.
-
AINS, Aspirine
Ils entraînent une diminution de la biosynthèse des prostaglandines et donc des anomalies du mucus.
- Helicobacter pylori (H.p.)
De nombreuses observations
montrent le rôle d’H.p. dans la pathogénie de l’ulcère gastro-duodénal. Les
deux principales sont :
·
virtuellement
tous les malades (95%) atteints d’ulcère duodénal sont porteurs du germe. Pour
les ulcères gastriques, la fréquence est moindre (± 70%), l’autre cofacteur important étant la
prise d’AINS.
·
l’éradication
de l’H.p. interrompt l’évolution naturelle de la maladie ulcéreuse.
Schéma physiologique du rôle de H.p. dans l’ulcère
gastro-duodénal :
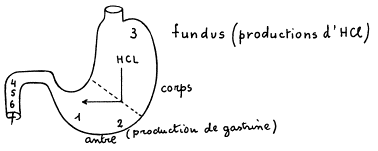
Fig. 13
1. Antrite à H.p.
2. Augmentation de la gastrine
3. Hypersécrétion acide
4. Métaplasie gastrique focale dans le duodénum en réponse à l’hyper-chlorhydrie
5. Colonisation d’un foyer de métaplasie duodénale par H.p.
6. Action cytotoxique et inflammation induite par H.p.
7. Ulcère.
La pathogénie de l’ulcère gastrique associée à H.p.
implique l’existence d’une pangastrite (antre, corps et fundus) induite par
H.p. souvent associée au développement ultérieur d’une métaplasie intestinale
et d’une atrophie.
- Flux sanguin muqueux
Sa diminution entrîne une
anoxie tissulaire (ex : ulcères de stress)
Facteurs de
défense
- Bicarbonate
(HCO-3)
La muqueuse antrale et
duodénale sécrète activement du bicarbonate qui crée dans la couche de mucus de
l’estomac et du duodénum un gradient de pH protégeant les cellules muqueuses
contre l’acide. La sécrétion bicarbonate est diminuée chez les ulcéreux
duodénaux.
- Mucus
Les muqueuses gastriques et
duodénales sont recouvertes d’une couche de mucus faite d’eau (85%) et de
glycoprotéines (15%). Ce gel muqueux peut être allégé par la toxicité des sels
biliaires (reflux duodénogastrique), des AINS (diminution de la synthèse des
prostaglandines qui ont un effet cyto-protecteur)ou d’H.p.
- Facteurs de croissance
Plusieurs peptides dont l’EGF
(epidermal growth factor), le TGF (transforming growth factor), la gastrine
sont impliqués dans la réparation tissulaire par effet paracrine. Leur
diminution ou leur stimulation (par le bismuth ou le sucralfate) peuvent
influencer la pathogénie ou le traitement de l’ulcère.
- Renouvellement
cellulaire
Des agents thérapeutiques
(antiacides, sucralfate) peuvent induire une guérison plus rapide de l’ulcère
par induction du processus de cicatrisation.
III. MANIFESTATIONS CLINIQUES
La douleur
est le principal symptôme de l’ulcère. Son caractère et son intensité sont très
variables et, chez de nombreux malades, il s’agit plus d’une gêne ou d’une
sensation d’inconfort que d’une vraie douleur. Elle survient sous forme de
« poussées » durant, en
l’absence de traitement, d’une à quelques semaines. La douleur ulcéreuse
typique apparaît tous les jours de deux
à quatre heures après les repas ainsi que la nuit (faim douloureuse). Elle
est calmée par l’ingestion d’alcalins ou
d’aliments. Cette douleur caractéristique n’est toutefois observée que chez
50% des ulcéreux.
L’ulcère peut être totalement asymptomatique et
éventuellement se révéler d’emblée par une complication (hémorragie,
perforation).
On observe parfois de la diarrhée et un
amaigrissement. Les vomissements sont rares. L’examen physique est peu
contributif.
IV. DIAGNOSTIC
L’endoscopie
est le premier examen à pratiquer en cas de suspicion d’ulcère gastro-duodénal. C’est également l’examen à
pratiquer pour suivre l’évolution des ulcères.
L’ulcère
gastrique
bénin se présente sous forme d’une ulcération ronde ou ovalaire à bords
réguliers et souples, à fond blanc crémeux et entourée de plis convergents. Le
prélèvement de biopsies de berges de l’ulcère (10 à 12) sera réalisé
systématiquement car des cancers gastriques peuvent donner des images
endoscopiques similaires à celles de l’ulcère bénin. Des prélèvements
au niveau de la muqueuse saine seront éventuellement pratiqués pour rechercher
une gastrite associée.
L’aspect macroscopique des ulcères duodénaux est très variable. L’ulcère rond, à
l’emporte-pièce est la forme la plus fréquente. Les ulcères linéaires de
diagnostic souvent difficile peuvent être mis en évidence par des colorations
spécifiques (bleu de méthylène). Le prélèvement de biopsies n’est pas
nécessaire, car le cancer duodénal est une affection extrêmement rare.
La recherche
de l’Helicobacter pylori (au niveau de l’antre et du corps) sera réalisée chez
tous les malades, en dehors de toute prise récente d’antibiotique ou d’IPP qui
induisent des faux négatifs .
L’étude du chimisme gastrique n’est indiquée que
chez les malades présentant des maladies ulcéreuses atypiques et,
éventuellement, chez ceux ne répondant pas au traitement médical. La détermination
de la gastrinémie est utile au moment du diagnostic primaire de la maladie mais
il est inutile de répéter cette mesure à chaque crise. Elle est à notre avis
indispensable lorsque l’on envisage d’opérer le malade.
V. COMPLICATIONS
1. L’hémorragie
L’hémorragie se manifeste par un méléna parfois
accompagné d’hématémèse. La voie de sortie du sang ne permet pas de localiser
l’ulcère, car l’apparition d’une hématémèse dépend plus du débit de
l’hémorragie que de la source du saignement. Certaines hémorragies peu
abondantes ne se traduiront que par une anémie.
Le diagnostic différentiel doit envisager les autres
causes d’hémorragie digestive haute (tableau II). Il sera réalisé par
endoscopie. Celle-ci sera pratiquée le plus rapidement possible après rétablissement
de la volémie si nécessaire.
|
TABLEAU II : CAUSES D’HEMORRAGIES DIGESTIVES HAUTES |
|
|
CAUSES |
FREQUENCE |
|
1.
Ulcère gastro-duodénal 2.
Gastro-duodénites aiguës hémorragiques 3.
Varices œsophagiennes/gastropathie d’hypertension portale 4.
Syndrome de Mallory-Weiss 5.
Œsophagites ulcéro-nécrotiques 6.
Tumeurs 7.
Divers · Angiodysplasies · Ulcère de Dieulafoy · Hémobilie · Wirsungorrhagie · Fistule aorto-entérique |
50% 20% 10% 7% 3% 2% 8% |
La majorité (± 80%) des
hémorragies ulcéreuses s’arrêtent spontanément. La présence d’un état de
choc au moment de l’admission, la mise en évidence d’un jet artériel au niveau
de la lésion et l’observation d’un caillot recouvrant une lésion artérielle
(« vaisseau visible ») sont des arguments plaidant en faveur d’une
persistance ou d’une récidive probable de l’hémorragie.
2. La perforation en
péritoine libre
Dans plus de 90% des cas,
elle est située au niveau de la région juxta-pylorique. Chez environ 50% des
malades, la perforation est précédée de douleurs ulcéreuses.
Les symptômes sont en général
évidents. Une douleur abdominale
apparaît brutalement (coup de poignard). Elle est d’abord localisée à
l’épigastre, s’étend à la fosse iliaque droite puis se généralise à tout
l’abdomen. Elle irradie parfois aux épaules par irritation du diaphragme. Les
vomissements sont rares. L’arrêt des matières et des gaz est fréquent. A
l’examen clinique, on trouve les symptômes
classiques de l’abdomen aigu à prédominance péritonéale : douleur à la
palpation, défense, contracture (en général très marquée : ventre de bois),
péritonisme (rebound), absence de péristaltisme, cul-de-sac de Douglas bombant
et douloureux. Les signes de choc sont modérés en début d’évolution mais
deviennent plus importants lorsque la péritonite chimique se transforme en
péritonite bactérienne.
L’examen clinique est, en
général, suffisant pour poser le diagnostic. Chez ± 50% des maladies, la radiographie sans préparation de l’abdomen montrera la présence d’air
sous les coupoles diaphragmatiques. Dans les rares cas où un doute
diagnostique persiste, la cœlioscopie est l’examen complémentaire le plus
valide.
3. La perforation dans un
organe voisin
Les ulcères duodénaux, plus
rarement les ulcères gastriques, peuvent se perforer dans le pancréas. La douleur devient plus importante, plus continue et transfixiante. Par contre, les
signes péritonéaux sont alors atténués.
Des symptômes biliaires
apparaissent en cas de perforation vers les voies biliaires. Les fistules
gastro-coliques (devenues très rares en cas d’ulcère bénin) se manifestent par
de la diarrhée, avec éventuellement présence d’aliments non ou partiellement
digérés dans les selles et par un
amaigrissement. La fistule sera plus souvent mise en évidence par un lavement
baryté que par un transit baryté.
4. La sténose
Les sténoses ulcéreuses sont invariablement
localisées au niveau de la zone pylorique. Elles sont la conséquence, soit de
l’œdème et du spasme qui accompagnent la poussée ulcéreuse (sténose
réversible), soit d’une fibrose antrale ou pyloro-duodénale (sténose en général
irréversible). L’apparition de vomissements
répétés non bilieux doit faire évoquer le diagnostic de sténose. A l’examen
clinique, on notera la présence d’un clapotis
au niveau de la région épigastrique.
Un état d’alcalose métabolique
hypochlorémique et hypokaliémique avec déshydratation, oligurie et azotémie
s’installe rapidement dans les cas sévères.
L’endoscopie est indiquée pour déterminer la cause de la sténose pylorique. Le
transit oeso-gastrique apporte des informations complèmentaires. Le principal
diagnostic différentiel est celui de cancer gastrique distal sténosant.
Avant de procéder à des examens complémentaires, il est impératif de
vider l’estomac par une aspiration gastrique continue et de corriger les
troubles métaboliques.
5. La cancérisation
Le problème de la
cancérisation des ulcères gastriques (les ulcères duodénaux ne se cancérisent
jamais) fait l’objet depuis de nombreuses années de controverses. Il est en
grande partie purement académique. La fréquence des cancers gastriques est
certes plus élevée dans une population d’ulcéreux gastriques que dans une
population témoin, mais l’augmentation de fréquence est modeste (1 à 5%) et au
moins une partie de ces cancers se développe non pas à partir de l’ulcère, mais
à partir de lésions métaplasiques gastriques qui sont fréquentes dans la
maladie ulcéreuse gastrique. Plus important d’un point de vue pratique, des
cancers authentiques peuvent avoir l’aspect endoscopique d’un ulcère bénin. Il est donc indispensable en présence d’une
ulcération gastrique d’établir le caractère bénin ou malin de la lésion. Il
faut d’une part procéder systématiquement à des examens biopsiques et d’autre
part, s’assurer de la guérison totale de la lésion en fin de traitement. Le
transit gastrique en double contraste doit être réalisé car il révèle les
déformations des plis gastriques et de la paroi en général
VI. TRAITEMENT DE L’ULCERE
GASTRO-DUODENAL
|
PRINCIPES DU TRAITEMENT DE L’ULCERE GASTRO-DUODENAL NON COMPLIQUE |
|
Règles hygiéno-diététiques Eviter alcool,
tabac, aspirine, AINS Médicaments : Antiacides en attente de l’endoscopie ou du résultat de la recherche d’H. pylori Trithérapie,
pendant 7 jours si H.P. +: (IPP + 2 ATB ou RBC + 2 ATB) puis IPP ou RBC pendant 2 à 6 semaines IPP si H.P. -, pendant 4 à 8 semaines Chirurgie en cas d’ulcères réfractaires au traitement médical ou récidivants |
Principe général : le traitement est médical (et comporte d’emblée le traitement de la poussée ulcéreuse et la prévention de la récidive), la chirurgie étant réservée aux échecs du traitement médical.
ulcere non complique
A. TRAITEMENT MEDICAL
1. Règles
hygiéno-diététiques
Aucun régime n’est
nécessaire. Durant la période initiale de la « poussée » on
supprimera l’alcool et les aliments irritants, parce qu’ils sont mal tolérés.
Par contre, des conseils très stricts doivent être donnés en ce qui concerne le
tabac, l’aspirine et les AINS.
La période de repos et donc
l’incapacité de travail ne doit pas excéder celle durant laquelle le malade ressent
des douleurs importantes. L’hospitalisation ne se justifie qu’en cas de
complications.
2. Antiacides
De nombreux médicaments
accélérant la guérison des récidives ulcéreuses sont disponibles.
La neutralisation de la
sécrétion gastrique acide par des substances alcalines ou possédant un pouvoir
tampon élevé (antiacides) a été
durant de nombreuses années le seul traitement médicamenteux de la maladie
ulcéreuse. Ces antiacides ne sont actuellement plus utilisés qu’à titre
temporaire pour leur action antalgique rapide avant l’endoscopie. Les formes à
base d’hydroxyde de Mg et d’Al seront préférées. Les antiacides sont, en
général, administrés sous forme de comprimés ou de solution en période post
prandiale ou au coucher.
3. Recherche
d’Helicobacter pylori
a. HP+
Le traitement repose sur une
trithérapie de 7 jours soit à base
de RBC (ranitidine bismuth citrate + 2 antibiotiques), soit à base
d’inhibiteurs de la pompe à proton (IPP + 2 antibiotiques).
Les schémas actuellement retenus sont :
·
IPP double dose
amoxicilline 2 x 1 g/jour
clarithromycine 2 x 500 mg/jour
ou
·
ranitidine
bismuth citrate
amoxicilline 2 x 1
g/j
clarithromycine 2 x 500 mg/j
et permet d’obtenir un taux d’éradication d’H.p. de
90% et la récidive est exceptionnelle (± 1% /an liée à une
recrudescence et non une réinfection). Les IPP ou la ranitidine bismuth citrate
sont prolongés pour accélérer la cicatrisation de l’ulcère pendant 2 semaines
pour l’ulcère duodénal et 6 semaines pour l’ulcère gastrique.
b. H.p.-
Il faut rechercher un autre facteur étiologique à
l’ulcère : prise d’aspirine ou d’AINS, ulcère néoplasique (pour l’ulcère
gastrique), maladie de Crohn, syndrome de Zollinger-Ellison, une hypersécrétion
acide (par tubage). Outre l’élimination du facteur causal, on prescrira des
antisécrétoires acides à court terme (4 à 8 semaines). Si la prise d’AINS doit
être poursuivie on coprescrira des IPP.
4. Contrôle de l’éradication d’H.p.
Il se fera soit au cours d’une endoscopie de contrôle en cas d’ulcère initialement compliqué ou
restant symptomatique ou par test
respiratoire à l’urée C14 ou C13 réalisé au plus tôt
un mois après la fin du traitement de l’ulcère.
En cas d’échec de l’éradication, un second
traitement sera proposé : il s’agit d’une quadrithérapie : IPP, RBC, tétracycline, métronidazole pendant 7
jours.
Cette quadrithérapie sera prescrite en première
intention en cas d’allergie à la pénicilline.
5. Contrôle endoscopique
Une endoscopie
de contrôle est indiquée.
1.
pour
l’ulcère gastrique après 8 semaines de traitement (avec biopsies pour exclure
une malignité). En l’absence de cicatrisation, un deuxième traitement médical
sera proposé avec endoscopie à la fin de cette deuxième période. En l’absence
de cicatrisation, une intervention chirurgicale devra être discutée.
2.
en
cas d’ulcère duodénal toujours symptomatique après un premier traitement ou
d’ulcère qui s’était compliqué.
B. TRAITEMENT
CHIRURGICAL
Les indications chirurgicales pour l’ulcère
gastroduodénal non compliqué sont devenues rares depuis l’efficacité de
l’éradication d’H.p. sur les récidives. Elles concernent : les ulcères non cicatrisés (en particulier l’ulcère gastrique avec
son risque de cancer sous-jacent), les
ulcères récidivants malgré l’éradication d’H.p. et les ulcères restant H.p.+ malgré plusieurs essais d’éradication, en
particulier chez les patients jeunes, non compliants indisciplinés et donc peu
susceptibles de suivre un traitement médicamenteux prolongé et en l’absence de
contre-indications (âge, affections associées).
Ulcère
complique : traitement medical et chirurgical
Ulcere hemorragique :
Un traitement médical sera suffisant chez 80% des
malades. Le volume sanguin sera restauré sans délai. Un traitement par IPP I.V.
sera entrepris. L’alimentation sera reprise le plus rapidement possible.
En cas de persistance de l’hémorragie ou de signes
endoscopiques laissant prévoir une récidive, un traitement endoscopique sera réalisé. Diverses méthodes sont
disponibles : électrocoagulation bipolaire, thermo-coagulation, injection dans
ou au voisinage de l’ulcère d’adrénaline, d’alcool ou d’un produit sclérosant.
Les complications sont rares et le traitement sera, au moins à titre
temporaire, efficace chez 75 à 100 % des malades. Le traitement pourra
éventuellement être répété. Il diminue la quantité de sang à administrer et le
nombre total des malades devant être opérés.
En cas d’échec
du traitement endoscopique, une intervention chirurgicale sera pratiquée sans
délai. Il
est dangereux de postposer trop
longtemps l’intervention chirurgicale, car la mortalité augmente à chaque
récidive surtout chez les vieillards. Les ulcères gastriques seront traités par
gastrectomie subtotale, emportant la lésion. Pour les ulcères duodénaux, une
gastrectomie selon Polya supprime la portion sécrétoire de l’estomac et
déconnecte le bulbe duodénal de sa vascularisation (a ; gastro-duodénale)
et des sécrétions et aliments.
Ulcere perfore :
L’ulcère perforé en péritoine libre ou induisant un
tableau « péritonéal » doit faire l’objet d’une exploration
chirurgicale idéalement coelioscopique. On repérera la perforation qui fera
l’objet d’une raphie. La cavité péritonéale sera lavée et drainée.
En cas de stabilité clinique (ulcére perforé
couvert), certains proposent un traitement par aspiration gastrique, IPP I.V., antibiothérapie
avec ou sans dialyse péritonéale.
Ulcere stenosant :
Une sténose d’apparition brutale est souvent
fonctionnelle. Un traitement médical s’impose. Il comporte en premier lieu la
mise en place d’une sonde d’aspiration naso-gastrique et la rééquilibration
hydro-électrolytique. Un traitement parentéral par antisécrétoires sera
instauré. Si la sténose persiste plus de quelques jours, une antrectomie
vagotomie est proposée.
Lorsque la sténose se développe progressivement, il
s’agit d’une indication chirurgicale. Quelques succès ont été obtenus par
dilatation endoscopique. Si la maladie ulcérée n’est plus active,
une pyloroplastie peut être suffisante mais le chirurgien préférera
réaliser un geste thérapeutique plus orienté vers la guérison de la maladie
ulcérée (antrectomie + vagotomie sélective).
VII.
LES INTERVENTIONS
CHIRURGICALES DANS L’ULCERE GASTRO-DUODENAL
A. PRINCIPES
DES INDICATIONS DU TRAITEMENT CHIRURGICAL
1. Les gastrectomies
La gastrectomie
subtotale pour ulcère comporte la résection de l’antre, d’une partie du
corps (50 à 75%) et du bulbe duodénal. La continuité digestive est rétablie par
anastomose le plus souvent gastro-jéjunale (Polya).
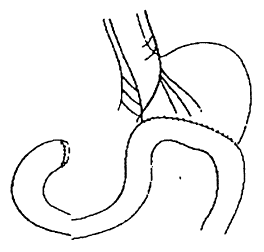
Fig. 14 : Gastrectomie subtotale
1.
Les vagotomies
Depuis l’avènement des IPP, les
vagotomies ne sont plus indiquées que dans des cas et circonstances
particuliers : ulcères récidivants après traitement médical bien conduit
chez le sujet jeune (<35 ans), non accès aux antibiotiques et/ou aux IPP
(pays non-industrialisés. Dans ces circonstances on peut réaliser par
coelioscopie, par laparotomie ou thoracoscopie, les procédés suivants :
Le traitement chirurgical de l’ulcère duodénal est
basé sur le principe que l’acide (avec un cofacteur tel que H. pylori) est
délétère pour la muqueuse pyloro-duodénale et le seul but est donc de réduire l’acidité par vagotomie seule
qui supprime la stimulation de la sécrétion acide et/ou par antrectomie, qui
supprime l’endroit de production de la gastrine.
La pathogénie de l’ulcère gastrique étant moins
claire et le risque de cancer sous-jacent étant toujours présent, le traitement
chirurgical doit viser à réduire
l’acidité et réséquer l’ulcère et comprendre donc toujours une gastrectomie
associée à une vagotomie.
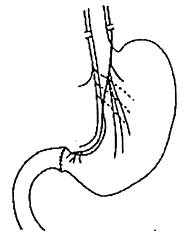
a. La
vagotomie sélective + drainage
Les troncs vagaux gauches et
droits sont sectionnés au niveau de l’orifice hiatal. La dénervation de la
région antro-pylorique provoque une dyskinésie antrale et un spasme pylorique. Une opération facilitant la vidange
gastrique (pyloroplastie ou gastro-entérostomie) doit être associée à la
vagotomie.
Fig. 15: Vagotomie sélective
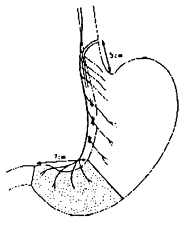 b. La vagotomie supra-sélective
b. La vagotomie supra-sélective
La section sélective des branches vagales innervant
le fundus, avec préservation du nerf de Latarjet et donc de l’innervation
antrale, a des effets antisécrétoires et thérapeutiques semblables à ceux de
vagotomies moins sélectives.
A long terme, le risque de
récidive d’ulcère est de 9 à 15%.
Fig. 16 : Vagotomie supra-sélective
3. Les opérations combinées
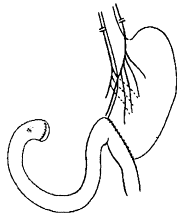 Pour obtenir une réduction
importante de la sécrétion gastrique tout en conservant à l’estomac une
fonction « réservoir » meilleure que celle des gastrectomies
classiques, on peut associer une vagotomie tronculaire ou sélective à une
résection gastrique limitée à l’antre. La continuité digestive est, en général,
rétablie par une anastomose gastro-jéjunale. Pour des raisons évidentes,
l’opération « combinée » est celle qui provoque la réduction la plus
importante de la sécrétion gastrique et le taux de récidive le plus bas.
Pour obtenir une réduction
importante de la sécrétion gastrique tout en conservant à l’estomac une
fonction « réservoir » meilleure que celle des gastrectomies
classiques, on peut associer une vagotomie tronculaire ou sélective à une
résection gastrique limitée à l’antre. La continuité digestive est, en général,
rétablie par une anastomose gastro-jéjunale. Pour des raisons évidentes,
l’opération « combinée » est celle qui provoque la réduction la plus
importante de la sécrétion gastrique et le taux de récidive le plus bas.
Fig. 17 : Vagotomie + antrectomie
C. PATHOLOGIE DE L’ESTOMAC OPERE
Bien que le nombre d’interventions chirurgicales
pour ulcère soit en diminution, la pathologie de l’estomac opéré est encore
fréquemment rencontrée. Aucun de ces troubles postopératoires n’est spécifique
du type d’intervention réalisée, mais la fréquence de leur apparition dépend de
celui-ci. Contrairement à une opinion souvent admise, les effets secondaires
des interventions gastriques peuvent, chez la majorité des malades, être
traités efficacement soit médicalement, soit chirurgicalement.
1. Le dumping syndrome
Le dumping syndrome associe des troubles digestifs (sensation de réplétion gastrique,
nausées, diarrhée) à des troubles neurologiques et circulatoires (lipothymie,
somnolence, tachycardie, sudation). Les symptômes apparaissent de 5 à 30
minutes après le repas et peuvent durer de 1 à 2 heures. Ils disparaissent
rapidement lorsque le malade est placé en décubitus. La pathogénie du syndrome
est complexe. Le passage rapide des aliments dans le jéjunum et un appel d’eau
dans celui-ci sont les facteurs déclenchants. Une hypoglycémie et la libération
de sérotonine et de kinines interviennent également. Le dumping syndrome peut être prévenu chez la majorité des malades
(plus de 95%) par une modification du régime : absorption des liquides
entre les repas, abstention des aliments provoquant le syndrome comme les
produits dérivés du lait ou très sucrés, fractionnement des repas.
2. La gastrite de reflux biliaire
Le développement d’une gastrite atrophique est quasi
constant après résection gastrique et fréquent après vagotomie et drainage. Le
plus souvent asymptomatique (80 à 90% des cas), elle peut provoquer
l’apparition de symptômes caractéristiques : brûlures épigastriques augmentées durant la période postprandiale,
vomissements bilieux ne calmant pas la douleur. La dénutrition est rare.
L’endoscopie révèle la présence d’une gastrite érythémateuse et érosive. Le
traitement de base fait appel aux prokinétiques associés éventuellement aux
chélateurs des sels biliaires tels que la cholestyramine. Lorsque l’affection
est sévère et invalidante, une réintervention doit être proposée. Son principe
est de supprimer l’apport de bile dans l’estomac. Chez les malades ayant subi
une vagotomie, la suppression de la gastro-entérostomie ou la reconstruction du
pylore sera réalisée. Chez les malades soumis à une résection gastrique,
l’anastomose gastro-duodénale ou gastro-jéjunale latéro-latérale sera remplacée
par une anastomose gastro-jéjunale en Y, l’anse anastomosée à l’estomac ayant
une longueur d’au moins 60 cm. Une vagotomie sera réalisée pour éviter le
développement d’un ulcère anastomotique. Cette intervention est efficace chez
plus de 90% des malades.
3. Anémies et carences
Le développement d’une anémie par troubles de la résorption du fer et , mais à un degré
moindre, de la vitamine B12 et de l’acide folique, doit être systématiquement
recherché et traité. Une telle anémie est observée chez ± 30% des opérés. Une ostéomalacie subclinique ou une association mal définie
d’ostéomalacie et d’ostéoporose secondaire, dues entre autres, à une
malabsorption du calcium et de la vitamine D n’est pas rare. Le nombre de
fractures spontanées ou traumatiques est plus élevé chez les gastrectomisés que
dans une population normale. Une perte
de poids modérée (± 5kg) est habituelle et non
préoccupante.
4. La diarrhée
Des troubles moteurs gastriques et intestinaux sont
observés principalement après vagotomie tronculaire. Ils peuvent provoquer
l’apparition de diarrhées qui peuvent bénéficier d’un traitement par la
cholestyramine ou l’hydroxyde d’aluminium (indiquant que les sels biliaires
seraient impliqués dans la genèse de cette complication) ou par le loperamide
(vu le transit accéléré).
5. Les ulcères post-opératoires
Les récidives varient en fonction de l’expérience du
chirurgien (antrectomie ou vagotomie incomplètes) et du type d’intervention
chirurgicale.
Elles sont rares (0 à 2%) en cas d’antrectomie +
vagotomie et plus fréquentes (10 à 15%) en cas de vagotomie supersélective.
Elles sont traitées par les anti-sécrétoires acides.
6. Les cancers
Une augmentation de l’incidence de cancer gastrique
survenant 15 à 20 ans après résection gastrique est observée. Cette
augmentation est faible. Nous pensons donc qu’il n’est pas utile de surveiller
endoscopiquement tous les malades ayant subi des interventions gastriques, mais
un suivi clinique attentif s’impose.
CHAPITRE IV :
LES TUMEURS GASTRIQUES
I. LES TUMEURS BENIGNES
Des polypes bénins (hyperplasiques ou adénomateux),
analogues à ceux observés dans le côlon, peuvent être présents dans l’estomac.
Les tumeurs villeuses et endocrines (carcinoïdes, E.C.L. cells) sont très
rares. Une augmentation de l’incidence des polypes est observée dans la maladie
de Biermer. Les léiomyomes se développent à la fois vers l’intérieur et vers
l’extérieur de l’estomac. Ils s’ulcèrent par nécrose centrale. Ils se
présentent endoscopiquement et radiologiquement sous forme d’une masse
volumineuse mais régulière, recouverte de muqueuse normale ulcérée en son
centre. Des schwannomes, des tumeurs dysgénétiques (hamartomes) ou formées de
tissu pancréatique peuvent également
être observées. Le traitement comporte en ordre principal l’exérèse,
qui, suivant la nature et la taille de la lésion, peut être endoscopique ou
chirurgical.
II. LES TUMEURS MALIGNES
La majorité des tumeurs malignes gastriques sont des
adénocarcinomes (95%). Plus rares sont les lymphomes et les sarcomes.
A. L’ADENOCARCINOME
1. Epidémiologie
Le cancer gastrique est, après le cancer colique, la
tumeur maligne la plus fréquente du tube digestif. Il est deux fois plus
fréquent chez l’homme que chez la femme et son incidence augmente à partir de
50 ans.
Sa répartition géographique est caractéristique. La
France, la Belgique et les pays anglo-saxons sont des pays à risque moyen par
rapport au Japon, à la Finlande, au Chili et à certains pays africains. A
l’intérieur d’un pays comme la France, l’incidence est nettement plus élevée
dans certaines régions (Bretagne, Normandie). La carcinogenèse gastrique
multifactorielle. Parmi les facteurs expliquant la répartition géographique,
l’Helicobacteur pylori jouerait un rôle majeur. La fréquence de cancer
gastrique est de 2 à 6 fois plus élevée chez les porteurs d’Helicobacter pylori
que chez les sujets non porteurs. Des gastrites atrophiques se développent
plusieurs années après la colonisation de l’estomac elles s’accompagnent de
métaplasie intestinale et favorisent le développement de cancers.
Plus rarement, le cancer se développe à partir d’un
polype adénomateux. Parmi les autres facteurs de carcinogenèse, un rôle
important est attribué aux nitrosamines. L’alcalinisation du contenu gastrique,
spontanée, médicamenteuse ou chirurgicale, augmente le contenu en nitrosamines.
Le mode de préparation des aliments serait également important (poissons
fumés), celui de l’alcool et du tabac est douteux. L’amiante joue un rôle chez
les sujets exposés.
2. Anatomopathologie
La base des classifications actuelles est à la fois
macroscopique et microscopique.
a. Classification
macroscopique
Les cancers invasifs : dans la classification de Borrman (1926), encore d’actualité, les cancers sont distribués suivant un système de gradation qui va des tumeurs les moins agressives (I) aux plus agressives (IV).
Fig. 18 : Classification de Borrman
Les formes polyploïdes (I) constituent des masses
assez bien limitées à surface lobulée, parfois érodée superficiellement. La
paroi gastrique reste souple ou n’est envahie que de manière limitée. Les
cancers ulcéro-nodulaires (II) comportent toujours un large ulcère linéaire,
ovalaire ou en raquette de profondeur variable. Le fond apparaît nodulaire,
parsemé de débris nécrotiques. Les bords sont surélevés, ourlés. Les plus
s’arrêtent à distance de la lésion. Le type ulcéro-nodulaire est de loin le
plus fréquent. Les tumeurs ulcéro-végétantes (III) forment de larges masses à
surface lobulée ou nodulaire, parsemées d’ulcérations irrégulières. Le
carcinome infiltrant (IV) se manifeste par un épaississement et une induration
de la paroi gastrique. La muqueuse est peu modifiée ; on peut observer un
effacement des plis ; parfois, au contraire, les plus sont épaissis par une
infiltration massive de la sous-muqueuse. Si des ulcérations existent, elles
apparaissent longitudinales, fissulaires. Lorsque ce type de tumeur entreprend
une large partie de l’organe, on lui donne habituellement le nom de linite
plastique.
Les cancers
superficiels
: les « early cancers » sont définis par les auteurs japonais comme
des carcinomes confinés à la muqueuse ou à la muqueuse et à la sous-muqueuse
sans atteindre les couches musculaires.
La classification japonaise (Murakami) différencie
trois types de tumeurs superficielles : type I saillant où la tumeur se
projette dans la lumière gastrique ; type II superficiel où la modification de
la surface est presque imperceptible (IIA surélevé, IIB plan, IIC déprimé) et
enfin type III ulcéré qui montre une excavation de la paroi gastrique.
Fig. 19 : Classification de Murakimi
Les combinaisons de types sont fréquentes. Dans le type III l’ulcère malin peut
évoluer suivant un cycle de cicatrisation analogue à celui de l’ulcère
chronique bénin.
b. Classification
histologique
La quasi totalité des cancers gastriques sont des
adénocarcinomes. On rencontre, en outre, occasionnellement, des adénoacanthomes
et des carcinomes épidermoïdes. Leur pronostic est analogue à celui des
adénocarcinomes.
La classification la plus couramment utilisée est
celle de Lauren. Elle a le mérite de la simplicité mais elle laisse 10 0 15% de
tumeurs inclassables. Elle reconnaît deux types de tumeurs :
·
le
type intestinal se caractérise par
des structures glandulaires tapissées par des cellules cylindriques ou cubiques
à polarité apparente, possédant souvent une bordure en brosse. Ces tumeurs sont
éventuellement mucisécrétantes. La limite du néoplasme par rapport aux tissus
voisins est bien définie.
·
le
type diffus est constitué de
cellules peu cohésives, isolées ou groupées en petits amas infiltrant
diffusément le stroma. Les structures glandulaires abortives sont rares. La
sécrétion intracellulaire de mucus est abondante et diffuse (cellules en bague
à chaton). Les limites de la tumeur sont irrégulières, mal définies.
c. Etats pré-néoplasiques de la muqueuse gastrique
La dysplasie se caractérise par une désorganisation architecturale et
des atypies cytologiques. La gradation s’établit en 2 à 3 stades suivant les
auteurs. Les dysplasies de faible grade paraissent évoluer pendant de
nombreuses années inchangées ou peuvent même régresser. La dysplasie de haut
grade constitue un indicateur de malignité soit en signant la présence d’un
cancer concomitant, soit comme prédécesseur de ce dernier. Elle est
justiciable, après les contrôles appropriés, d’un traitement radical par
destruction locale ou exérèse chirurgicale. La dysplasie glandulaire représente
un précurseur éventuel des cancers de type intestinal. On ne connaît pas, par
contre, de manière précise les aspects histologiques d’une dysplasie liée au
développement des cancers de type diffus.
d. Dissémination
Le cancer gastrique montre
une propension à l’extension pariétale aussi bien en profondeur qu’en surface.
Il est, de ce fait, impératif de rechercher soigneusement sur toute pièce
opératoire les images d’envahissement de la séreuse et des marges de résection.
L’infiltration par contiguïté est fréquente. La greffe de cellules néoplasiques
sur le péritoine peut provoquer une ascite cancéreuse. Les implants ovariens
(tumeur de Krukenberg) induisent une réaction stomale source
d’hyperoestrogénisme ; les ovaires sont volumineux, fermes, bosselés.
Des métastases lymphatiques
sont décelées dans plus de 70% des pièces de résection. Selon la localisation
de la tumeur, les chaînes ganglionnaires de la petite ou de la grande courbure
sont entreprises. L’extension se fait vers les chaînes périaortiques et
médiastinales. Compte tenu du drainage veineux portal, les métastases
sanguines, fréquentes, se localisent en priorité dans le foie mais elles
peuvent se voir dans de nombreux autres sites.
e. Facteurs de pronostic
Le pronostic est conditionné par l’extension en profondeur et par les
métastases lymphatiques. Les tumeurs superficielles (early carcinoma) ne débordant pas la
sous-muqueuse et surtout les tumeurs intramuqueuses sont d’excellent pronostic
alors que le taux de survie moyen des cancers invasifs est mauvais (20% à 5 ans
pour l’ensemble des cas opérables). En l’absence d’envahissement lymphatique,
le taux de survie dépasse 50%. Lorsque 1 à 3 ganglions sont envahis, le pourcentage
de survie est de ± 30%. Si plus de 3 ganglions
sont envahis, la survie est de moins de 5%.
L’implication pronostique des
classifications est sujette à discussion. En ce qui concerne la classification
de Borrman, elle est utile pour les formes I et IV. Les tumeurs polyploïdes (I)
qui s’étendent, en général, peu en profondeur permettent des survies
relativement longues tandis que les tumeurs infiltrantes (IV) sont souvent
inopérables au moment du diagnostic. Les formes II et III présentent des survies
intermédiaires avec cependant de larges variations individuelles qui rendent la
classification peu utile pour ce type de lésions qui représentent
malheureusement près de 60% des observations.
D’un point de vue
histologique, les formes intestinales ont une évolution un peu plus favorable
que les formes diffuses.
3. Manifestations
cliniques
Il n’y a pas de symptômes
caractéristiques au début de l’évolution. Le diagnostic de cancer gastrique
sera évoqué dans les circonstances suivantes :
·
des
troubles digestifs banaux surtout s’ils sont accompagnés d’anorexie spécifique
pour la viande et les graisses et d’un dégoût du tabac.
·
une
symptomatologie douloureuse typique ou atypique d’ulcère.
·
une
hémorragie digestive.
·
une
dysphagie, une anémie hypochrome, un amaigrissement isolé.
A un stade avancé, on
observe de l’anorexie, des vomissements, de l’amaigrissement et une anémie. Une
masse peut être palpable au niveau de l’épigastre et l’on peut découvrir des
adénopathies sus-claviculaires (ganglion de Troisier) et une induration
néoplasique du cul de sac de Douglas.
Les complications les plus
fréquentes sont, dans l’ordre, la sténose, l’hémorragie et la perforation.
4. Diagnostic
L’endoscopie complétée par la prise de biopsies et un examen
anatomopathologique sera pratiquée en premier lieu.
La radiographie est un
complément indispensable à l’endoscopie. Elle permet, mieux que l’endoscopie,
d’estimer l’extension des lésions. Certaines formes (linite plastique)
difficiles à mettre en évidence en endoscopie peuvent être évidentes à la
radiographie.
Devant une ulcération, les
signes radiologiques suivants plaident en faveur d’une lésion néoplasique :
·
une
niche « en plateau »
·
des
contours irréguliers et bourgeonnants (images de tonalité)
·
une
rigidité des parois autour de l’ulcère
·
une
destruction des plis.
Les ulcères situés au niveau
de la petite courbure verticale sont bénins dans ± 90% des cas. Ce pourcentage
tombe à 50% pour les lésions antrales et à moins de 20% pour les lésions de la
grande courbure.
L’extension loco-régionale
et à distance sera évaluée par la tomodensitométrie, l’écho-endoscopie, le
lavement baryté, la radiographie du thorax, l’échographie hépatique et la
scintigraphie osseuse.
Le dosage de l’antigène
carcino-embryonnaire n’est pas utile au diagnostic mais sera pratiqué pour
suivre l’évolution de la maladie.
5. Traitement
Le traitement à visée
curative du cancer de l’estomac est la gastrectomie
élargie. Contrairement aux gastrectomies réalisées pour ulcère, les
gastrectomies pour cancer comportent l’exérèse du grand épiploon et un curage
des chaînes ganglionnaires pyloriques et coeliaques. La résection sera
éventuellement étendue à la rate, à la queue du pancréas et au côlon.

Fig. 21 : Gastrectomies sub-totale et totale
La gastrectomie sera subtotale distale pour les lésions antrales,
totale avec anastomose oeso-jéjunale en Y pour les lésions du corps gastrique.
Lorsqu’il existe une
extension loco-régionale ou à distance rendant un traitement à visée curative
illusoire, une résection gastrique simple ou élargie aux organes voisins sera
proposée, car, à défaut de prolonger la survie, elle assure au malade, à titre
temporaire, un meilleur confort et évite les complications (hémorragies,
sténoses). La gastro-entérostomie de dérivation ainsi que les gastrotomies ou
jéjunostomies palliatives ne seront utilisées qu’en cas de lésion non
réséquable.
Les traitements adjuvants
(radiothérapie et chimiothérapie) sont, à ce jour, décevants en terme de survie
et leurs indications restent controversées.
La seule méthode permettant
d’espérer une amélioration de la survie est le diagnostic précoce. Dans les
pays à forte incidence (Japon), des campagnes de dépistage par endoscopie,
analogues à celles que nous connaissons pour la tuberculose, ont été instaurées.
De telles campagnes ne sont pas justifiées dans notre pays. On se limitera à la
surveillance endoscopique annuelle des malades à haut risque.
B. LES LYMPHOMES
1. Anatomopathologie
a. Considérations générales
Le tube digestif est la
localisation la plus fréquente des lymphomes extra-ganglionnaires. Ces
derniers prennent naissance à partir du tissu lymphoïde spécialisé des
muqueuses (MALT : Mucosa Associated Lymphoid Tissue) et sont, pour la plupart,
de type B.
On décrit deux grands types
:
·
de
bas grade qui reproduisent assez fidèlement les caractéristiques des
populations cellulaires des plaques de Peyer.
·
de
haut grade qui sont constitués de populations cellulaires homogènes de type
blastique.
Les lymphomes primitifs se
cantonnent au tube digestif et à son réseau lymphatique ; les métastases dans
d’autres organes sont rares et tardives. Ils doivent être distingués (sur base
de leur présentation clinique et de leur extension) des envahissements
secondaires, fréquents, du tube digestif par des lymphomes ganglionnaires.
L’estomac est un des sites
les plus communs des lymphomes de type MALT. Les lymphomes représentent 5% des
tumeurs malignes de l’estomac. Leur incidence paraît en augmentation. Ils se
voient chez les patients âgés (après 50 ans, pic d’incidence vers 70 ans).
Environ la moitié sont de faible degré de malignité.
La prédilection des
lymphomes pour l’estomac paraît d’autant plus étonnante qu’il n’y a pas de
tissu lymphoïde organisé dans l’estomac normal. Par contre, l’accumulation de tissu
lymphoïde de type MALT est la règle dans les infections à Helicobacter et est
pratiquement pathognomonique de cette dernière. Un lien étroit entre cette
stimulation antigénique du tissu lymphoïde gastrique par Helicobacter et le
développement des lymphomes paraît hautement probable en se basant sur des
études in vitro, des considérations épidémiologiques et sur la régression de
certains lymphomes gastriques sous traitement antibiotique dirigé contre
Helicobacter.
b. Examen macroscopique
L’image macroscopique d’un
lymphome gastrique primitif est assez semblable à celle d’un adénocarcinome ;
ces tumeurs sont plus souvent multiples que les adénocarcinomes. La présence de
gros plis en périphérie de la lésion peut constituer un élément de diagnostic
important de même que le caractère infiltrant de la lésion.
c. Examen histologique
Alors que le diagnostic de
lymphome est relativement simple sur pièce opératoire, il peut poser des
problèmes ardus sur des biopsies endoscopiques où il importe de différencier la
prolifération tumorale d’une hyperplasie lymphoïde réactionnelle que l’on peut
rencontrer en bordure d’ulcères ou de cicatrices d’ulcères. Les caractères de
discrimination sont les complexes lympho-épithéliaux formés par la pénétration
de cellules lymphomateuses dans les parois glandulaires et le caractère
monoclonal de la population cellulaire. Ce dernier type de recherche nécessite
des techniques spéciales (immunocytochimie en congélation, biologie
moléculaire).
2. Manifestations
cliniques et traitement
Les symptômes cliniques des
lymphomes sont les mêmes que ceux des adénocarcinomes. L’endoscopie et la
radiographie montrent la présence de gros plis ou de zones d’infiltration
accompagnée d’hyperémie et d’ulcérations superficielles.
Contrairement aux lymphomes
ganglionnaires de bas grade qui, après une réaction initiale favorable au
traitement chimiothérapique, entraînent la mort quelques années après le
diagnostic, la survie à longue échéance des lymphomes gastriques de bas grade
est excellente (75% en 10 ans) quel que soit le mode de traitement (chirurgie,
chimiothérapie). Le pronostic des lymphomes de haut degré de malignité est
nettement moins bon (50-60% à 5 ans).
Des régressions et même des
disparitions de masses lymphomateuses ont été observées après un traitement par
triple association antibiotique et éradication de Helicobacter pylori. Ces
régressions paraissent limitées aux lymphomes de bas grade et le suivi des
patients est encore insuffisant à l’heure actuelle pour apprécier pleinement la
valeur de ce type de traitement.
C. LES SARCOMES
Les sarcomes sont très rares
en dehors du léiomyosarcome (cf tumeurs stromales). Le développement peut se
faire vers l’intérieur ou vers l’extérieur de l’estomac. L’ulcération de la
tumeur et les hémorragies sont fréquentes.
Tumeurs stromales : elles correspondant à l’ancienne nomenclature de léiomyome et
léiomyosarcome. Cette nouvelle terminologie se justifie par deux arguments :
a) les tumeurs classées
anciennement comme léiomyome (ou léiomyosarcome) ne sont probablement pas
toutes d’origine musculaire lisse ;
b) les critères de malignité
sont difficiles à évaluer (mitoses, ...) et une distinction de deux catégories
bénin malin est peu réaliste.
Les tumeurs stromales gastriques affectent deux présentations différentes.
Il peut s’agir de lésions de
petite taille (quelques millimètres) que l’on rencontre fréquemment à
l’autopsie et dont l’histologie est strictement bénigne.
Des lésions plus
volumineuses, donnant lieu à une symptomatologie clinique, se présentent sous
forme de masses régulières soulevant la muqueuse. Le centre est fréquemment
excavé. Leur ulcération peut donner lieu à des hémorragies. Le pathologiste
s’efforcera de préciser le risque de malignité en calculant l’index mitotique.
Il exprimera ce risque sous forme de « utmeur probablement maligne, tumeur
de comportement difficilement prévisible, tumeur probablement bénigne ».
La dyspepsie survient chez 30 à 40% des populations européennes. Elle est responsable de près de 5% des consultations du médecin généraliste.
Le terme de dyspepsie est
utilisé d’une manière ambiguë. Sensu stricto, il est dérivé du grec dns peptein (mauvaise digestion) et
désigne un inconfort abdominal haut attribué à un dysfonction-nement du tractus
digestif supérieur. Ce dysfonctionnement peut être dû à une maladie organique
identifiable ou à des troubles uniquement fonctionnels.
1. Physiopathologie
Les techniques manométriques
ou électromyographies ont mis en évidence divers troubles de la motricité gastro-duodénale : hypomotilité antrale,
hypermotilité inefficace (tachygastrie, tachyarythmie), responsables d’une
vidange gastrique ralentie. Ces troubles sont cependant loin d’être constants.
Le rôle de l’Helicobacter
pylori, quoique présent chez 50% des malades est controversé.
Des troubles de la sensibilité digestive peuvent intervenir en
association ou non avec des troubles de la motilité.
Les facteurs psychologiques jouent un rôle indiscutable.
2. Manifestations
cliniques
Les manifestations cliniques de la dyspepsie sont protéiformes. Un ou plusieurs des symptômes suivants sont observés :
·
Des
douleurs,
·
Du
pyrosis,
·
Une
sensation de plénitude gastrique,
·
Une
sensation de ballonnement,
·
Des
nausées et des vomissements.
L’examen physique est totalement normal.
3. Diagnostic
Le diagnostic de dyspepsie
repose essentiellement sur des arguments négatifs démontrant l’absence
d’organicité dans la responsabilité des plaintes du sujet.
Les affections suivantes
doivent être éliminées :
·
Reflux gastro-oesophagien
·
Ulcère gastro-duodénal
·
Gastrite
·
Cancer
gastrique
·
Lambliase,
maladie coeliaque
·
Côlon
irritable
·
Pancréatite,
cancer du pancréas
·
Lithiase
biliaire
·
Diabète,
hyperparathyroïdie, dysthyroïdie
·
Troubles
électrolytiques
4. Traitement
Il convient avant tout de
rassurer le patient. On lui conseillera d’éviter les aliments déclenchant les
symptômes, le café, le tabac et l’alcool.
La dyspepsie de type
ulcéreux (douleurs) sera traitée par les antiacides ou les antiH2. Pour la
dyspepsie de type reflux, on prescrira des alginates, des prokinétiques ou des
anti H2. Si les symptômes prédominants sont l’aérophagie et la
flatulence, de la siméticone (Kestomatinâ) ou du charbon (Aérogastolâ) peuvent apporter un certain soulagement.
Les dyspepsies de type dysmotilité seront traitées par des prokinétiques.
5. Attitude pratique
Quoique le diagnostic de
dyspepsie soit un diagnostic d’exclusion, il faut être économe des moyens
d’investigation.
Lorsque la dyspepsie
survient chez un malade de moins de 45 ans, qu’elle est de type ulcéreux, qu’il
n’y a pas de symptômes d’alarme (perte de poids, dysphagie, saignement
gastro-intestinal, anémie), qu’il n’y a pas de prise d’AINS et qu’une recherche
non invasive de l’H.p. est positive, un traitement d’éradication de l’H.p. peut
être instauré d’emblée.
Dans le cas contraire, on
pratiquera dans un premier stade les examens suivants :
·
Examen
hématologique, VS, ionogramme, glycémie, calcémie
·
Tests
hépatiques et pancréatiques
·
Echographie
du foie de la vésicule et du pancréas
·
Endoscopie
haute avec biopsies.
Lorsque ces examens sont
insuffisants on réalisera :
·
Une
pHmétrie de 24 heures et une manométrie œsophagienne
·
Une
côlonoscopie ou un lavement baryté
·
Une
étude isotopique de la vidange gastrique
·
Une
tomodensitométrie du pancréas.
CHAPITRE VI :
L’OBESITE MORBIDE
I. DEFINITION
Depuis de multiples décennies, la médecine et la
Santé Publique sont confrontées à la surcharge pondérale et à ses conséquences
sur le bien-être physique, psychologique et socioprofessionnel.
Depuis la deuxième guerre mondiale et l’accès à une
pléthore des produits alimentaires, les pays occidentaux ont vu accroître
l’incidence de l’obésité.
Il s’est avéré nécessaire de définir le surpoids,
l’obésité et l’obésité morbide, d’en cerner les conséquences en terme de
morbidité et de mortalité et d’en trouver des solutions.
Si l’étiopathogénie reste multifactorielle, la
stratégie médico-chirurgicale a évolué favorablement au cours des dernières
années. Précédés par des compagnies d’assurance qui ont, les premières, établi
les courbes de survie actuarielle des patients en fonction du poids, les
responsables de la Santé Publique ont poussé les cliniciens à prendre ce
problème en charge.
L’obésité est définie comme étant une accumulation
sous-cutanée et intra-abdominale de tissus adipeux. Cette accumulation est
consécutive à un apport alimentaire excessif par rapport au métabolisme de base
et aux besoins réels de l’individu.
Actuellement, de manière internationale, l’obésité
est calculé par l’index de masse corporelle (Body Mass Index : BMI) qui
équivaut au quotient du poids en kilo sur la taille exprimée en mètre au carré
(poids kg/(taille)²m). Un BMI de 25 à 30 signe un surpoids. L’obésité qualifie
le BMI de 30 à 40. Cette obésité devient morbide à partir de 40 ou à partir de
35 si l’un des 5 critères de l’association américaine des soins de santé est
rempli.
Ces critères sont :
-
Insuffisance
cardio-respiratoire
-
Diabète
-
Hypertension
artérielle
-
Syndrome
d’apnées du sommeil
-
Problèmes
ostéo-articulaires
II. ETIOPATHOGENIE
1.
Aspects génétiques
La mise en évidence de
mutants obèses chez les rongeurs et l’apparition d’obésité familiale confirment
l’impact de certaines mutations sur l’accumulation de graisses dans les
adipocytes. Si plusieurs loci sont incriminés, les recherches sur les banques
d’ADN actuellement en cours devraient éclairer cet aspect dans les prochaines
années. La thérapie génique pourrait devenir d’ici 10 ou 20 ans une des
alternatives thérapeutiques.
2.
Aspects environnementaux
Les guerres, les famines et
les catastrophes naturelles ont démontré que l’obésité disparaissait en cas de
privation alimentaire. Inversement, l’obésité morbide apparaît dans les pays où
la pléthore alimentaire est quotidienne et où les habitudes ont entraîné la potomanie
aux boissons sucrées, l’éthylisme et le grignotage pendant les heures de
travail et de loisir. L’absence d’activité sportive, le sédentarisme, jouent un
rôle prédominant.
3.
Aspects psychosociaux
Au niveau de chaque individu obèse, l’environnement
socioprofessionnel et familial joue un rôle déterminant. Les facteurs
dépressifs sont en général associés à de la boulimie et à des modifications du
comportement alimentaire. S’il est quelquefois difficile de discerner la
dépression secondaire induite par l’obésité morbide et la boulimie secondaire à
un phénomène dépressif endogène, ces facteurs font toujours l’objet d’une
évaluation précise surtout lors de la décision d’un traitement chirurgical.
III. CONSEQUENCES DE L’OBESITE MORBIDE ET BILAN PLURIDISCIPLINAIRE
La chute de survie actuarielle à partir d’un BMI à
35 objectivé par les statistiques des compagnies d’assurance est illustrée par
l’accroissement des pathologies induites par l’obésité morbide. Les risques
cardio-vasculaires (infarctus, thrombose vasculaire cérébrale, accident
hémorragique, artériopathie périphérique) qui constituent 40% des causes de
mortalité de la population normale, induisent une mortalité à plus de 50% en
cas d’obésité morbide. On constate également une augmentation du nombre d’accidents
et de la mortalité induite par le diabète.
Il faut également signaler l’augmentation de
certains cancers, les arrêts respiratoires pendant le sommeil, la stérilité et
la mortalité induites par les pathologies orthopédiques graves.
La pathologie biliaire associée conduit plus à un
accroissement de morbidité que de mortalité.
Tous ces éléments conduisent à la nécessité d’un
bilan multidisciplinaire en cas d’obésité morbide.
Ce bilan nécessite :
Une enquête diététique,
Un entretien psychologique,
Un bilan endoscopique,
Un bilan cardio-vasculaire,
Un bilan endocrinien.
L’enquête diététique permet de différencier les
grands mangeurs centrés essentiellement sur des repas gargantuesques 2 à 3 fois
par jour, des grignoteurs et de la potomanie aux boissons sucrées.
Le bilan psychologique permet de cerner la
présence de phénomènes dépressifs.
La gastroscopie permet de déterminer la
présence d’oesophagite (30% des patients obèses), d’une gastrite (17%) voire
d’ulcères gastro-duodénaux (20%).
L’association avec les hernies hiatales et le reflux
gastro-oesophagien nécessite la prise en charge par inhibiteurs de la pompe à
protons avant toute décision chirurgicale. Le caractère asymptomatique des
lésions gastriques associées nécessite un dépistage systématique.
Le bilan endocrinien permet également d’éliminer
la présence d’une hypothyroïdie, d’un syndrome de Cushing, ou d’autres
anomalies métaboliques et endocriniennes interférant avec l’obésité morbide. Ce
bilan multidisciplinaire conduit à différencier la plainte référentielle (1)
BMI, 2) problèmes orthopédiques, 3) hypertension artérielle, 4) apnées du
sommeil, 5) insuffisance cardio-respiratoire) du bilan médical démontrant un
impact différent des pathologies réellement associées (&) reflux gastro-oesophagien
et maladies gastro-duodénales, 2) problèmes orthopédiques, 3) hypertension
artérielle, 4) insuffisance cardio-respiratoire, 5) diabète, 6) apnées
désaturantes du sommeil).
A. STRATEGIES THERAPEUTIQUES – EVOLUTION DES CONCEPTS
Depuis les précautions diététiques jusqu’à la
chirurgie bariatrice, les dernières décennies ont vu évoluer considérablement
les techniques thérapeutiques.
La prise en charge diététique reste indispensable,
mais elle a démontré son inefficacité comme thérapeutique isolée de l’obésité
morbide. Les cures de jeûne en vogue dans les années 70 et 80 ont été
pratiquement abandonnées à cause du taux élevé de récidive et de l’absence de
follow-up. La prise d’anorexigènes est extrêmement dangereuse et dorénavant
interdite. La psychothérapie qui reste un des bras de levier thérapeutique ne
peut être efficace qu’associée à une prise en charge chirurgicale. Les ballons
intra-gastriques positionnés par endoscopie ont été également abandonnés du
fait de l’habitude de l’estomac aux corps étrangers.
Les procédés chirurgicaux ont eux également évolué.
Après les procédés fantaisistes incluant la fixation des maxillaires par une
prothèse, la mise en place d’anneaux sur l’oesophage, les alternatives
chirurgicales se sont progressivement centrées sur :
1. Les bypass (bypass grêle, bypass bilio-pancréatique et bypass gastrique)
Le by-pass gastrique est
prôné par les anglo-saxons dans les cas de « sweeteaters » ou les
anciens éthyliques, que les Européeens évitent d’opérer.
Le bypass grêle est
abandonné mais le by-pass bilio-pancréatique connaît un nouvel intérêt, malgré
le risque de malabsorption sévère, avec risque d’insuffisance hépatique. Il n’a
aucun impact sur l’apport alimentaire. Il est indiqué en cas d’hyperobésité
(BMI > 50).
2.
Les banding
Les banding gastriques horizontaux calibrés ou ajustables sont en vogue dans certains centres notamment en Belgique et en Italie. Si certains centres américains et scandinaves semblent être découragés par cette méthode (reflux gastro-oesophagien et morbidité importante), elle garde un attrait du fait de la facilité de l’abord coelioscopique et de la réversibilité ultérieure(?).
3. Les gastroplasties
Si les procédés
horizontaux ont été abandonnés, la gastroplastie verticale reste actuellement
le standard dans la littérature internationale. La gastroplastie verticale
selon Mason a démontré une efficacité à long terme. Elle présente de multiples
variantes dont la gastroplastie verticale avec anneau de Silastic qui permet un
abord par mini-laparotomie, une surveillance ou des recalibrages endoscopiques
et un excellent rapport qualité-prix.
Fig. 21 : Gastroplastie
verticale
Quel que soit le procédé
chirurgical envisagé (gastroplastie verticale ou banding), les critères de
sélection doivent être remplis.
B. CRITERES DE SELECTION OPERATOIRE
1. Les critères d’inclusion sont :
18
à 55 ans
Obésité
vraie et stable depuis plus de 5 ans
BMI
supérieur à 39
BMI
entre 35 et 39 si apnées désaturantes, arthrose objectivée, diabète,
hypertension artérielle ou insuffisance cardio-respiratoire
Echec
de mesure diététique.
2. Les critères d’exclusion relatifs sont :
Déséquilibre
socio-économique
Problèmes
conjugaux
Antécédents
de chirurgie gastrique
Maladie
ulcéreuse active.
3. Les critères d’exclusion absolus sont :
Ethylisme
Pathologie psychiatrique
active
Niveau intellectuel
inapproprié
Potomanie aux boissons
sucrées
Manque de motivation
Dentition ravagée et non
traitée
Le bilan préopératoire
doit comporter outre les 5 bilans médicaux déjà cités, une biologie usuelle,
une radiographie de thorax, une échographie des voies biliaires, la recherche
du Cortisol urinaire, des épreuves respiratoires fonctionnelles, une
gazométrie, une polysonographie de sommeil (en cas de suspicion d’ADS), une
scintigraphie de transit gastrique (si suspicion de gastroparésie). A l’issue
de ce bilan, une évaluation et une concertation multidisciplinaire infirment ou
confirment l’indication opératoire.
C. TRAITEMENT CHIRURGICAL
La littérature
internationale est partagée entre le banding ajustable et la gastroplastie mais
la plupart des centres universitaires proposent la gastroplastie verticale. Elle est en général réalisée par
laparotomie conventionnelle, mini-laparotomie ou plus rarement par voie
coelio-assistée. Elle consiste en la libération de la jonction oeso-cardiale,
la fenestration au niveau de la petite courbure et un agrafage vertical de 90
mm. Le réservoir ainsi constitué communique avec le restant de l’estomac par un
orifice calibré par un anneau de Silastic de 50 à 55 mm de diamètre.
L’opération de Mason
consiste en un agrafage circulaire au bord de la petite courbure, l’agra-fage
vertical le long de la sonde de Fauchez et la mise en place d’un banding de 1
cm de large.



|
Fig.21 :Gastroplastie
selon MASON
|
Fig.22 :
Silastic.Ring.V.G. |
Fig.23 :
Gastroplastie antireflux |
|
Fig.24 :
|
|
Fig.25 : Vue opératoire
d’une S.R.V.G. par mini-laparotomie |
|
Fig.26 : By-pass gastrique |
Fig.27 : By-pass selon Scopinaro |
Fig.28 : By-pass 1 m / Gastrec.tot. |
D. COMPLICATIONS.
1. Complications médicales
Précoces :
Pneumopathie : 4%
Infections
urinaires : 3%
Thrombose
veineuse profonde : 1%
Tardives :
Carences
nutritionnelles : 12%
Lithiase
biliaire symptomatique 3%
Hépatite
virale 3%
Neuropathies 2%
2. Complications chirurgicales
Les complications varient
essentiellement selon les techniques.
Les gastroplasties
exposent à la sténose annulaire ou à la désunion de la ligne d’agraphage ;
cela conduit à une récidive fréquente de l’obésité (recalibrage endoscopique 12%, éventrations 7%, désunion de la
ligne d’agrafes 3%, désertion de l’anneau 2%).
La mortalité est de 0.3 à
1% dans la littérature.
Le suivi à long terme
nécessite des contrôles endoscopiques (aussi bien pour la gastroplastie
verticale que pour les banding), un suivi psychosocial et diététique est
indispensable.
Le mécanisme d’action de
la gastroplastie verticale et des procédés de banding est fondamentalement
différent.
L’agrafage vertical
entraîne un effet de ralentissement du passage antro-duodénal démontré par les
tests de transit gastrique isotopique. Si le réservoir joue un rôle dans le
ralentissement du repas, le résultat à long terme semble lié au doublement du
temps de transit gastro-duodénal.
En revanche, le banding
sous-cardial crée un obstacle mécanique et induit plutôt une dysphagie aux
solides. La gastroplastie verticale calibrée est un procédé considéré comme
définitif bien que réversible par voie endoscopique ou coelioscopique pour une
obésité considérée comme à durée indéterminée. Le banding ajustable est un procédé
à la carte puisque la présence d’une pompe sous-cutanée permet de modifier le
calibre du banding à volonté.
Dans plus de 20 % des cas
le Banding peut se luxer et provoquer une obstruction gastrique.
CHAPITRE VII :
AFFECTIONS DIVERSES
1. Les corps étrangers
Lorsqu’un
corps étranger dégluti atteint l’estomac, il est généralement éliminé
spontanément. Son trajet dans le tube digestif
sera éventuellement suivi cliniquement (recherche des signes
d’irritation péritonéale) et radiologiquement. Lorsque sa taille dépasse 30 mm
ou s’il est pointu, il sera enlevé endoscopiquement.
Les phytobézoars sont constitués
de débris végétaux accumulés dans l’estomac. Ils sont très rares et observés
principalement chez des malades ayant subi une résection gastrique ou une
vagotomie. Plus rares encore sont les trichobézoards constituée par une
accumulation de cheveux.
2. Les diverticules duodénaux
Un examen radiologique ou
endoscopique peut, occasionnellement, révéler la présence d’un ou de plusieurs
diverticules au niveau du duodénum. Ces diverticules sont, pour la plupart,
situés au niveau du deuxième duodénum. Ils sont le plus souvent asymptomatiques
et ne doivent donc pas être traités. Occasionnellement, ils provoquent des
symptômes biliaires (angiocholite) par compression ou distorsion anatomique. La
réalisation d’une cholédocojéjunostomie sur anse en Y est indiquée chez ces
malades.
3. Les tumeurs duodénales
Les tumeurs duodénales primitives
sont très rares. Ce sont en général des adénomes, rarement des adénocarcinomes.
Les ampullomes Vatériens seront décrits dans le chapitre consacré à la
pathologie biliaire.
4. L’ulcère de Dieulafoy
Situés le plus souvent au
niveau du fundus gastrique, l’ulcère de Dieulafoy est une petite lésion centrée
sur un vaisseau. Il est probablement dû à une lésion congénitale vasculaire. Il
peut provoquer des hémorragies très abondantes.
Comme pour toutes les
maladies d’origine indéterminée, le traitement de la dyspepsie non ulcéreuse
est controversée. Il convient de rassurer le malade et lui conseiller d’éviter
le tabac, l’alcool et les AINS. Les antiacides sont inefficaces de l’action des
antisécrétoires douteuses. Le cisapride a donné quelques résultats dans des
études randomisées.




