CHAPITRE I : GENERALITES
I. FONCTIONS D’ABSORPTION ET DE SECRETION DE L’INTESTIN
A. FONCTIONS ET STRUCTURE DE L’INTESTIN
Les principales fonctions de l’intestin grêle et du côlon consistent à :
· Extraire de l’alimentation les nutriments ainsi que les minéraux et l’eau ;
· Maintenir (autant que possible) exclus les bactéries et les antigènes ;
· Assurer l’excrétion des déchets.
La longueur et la surface d’absorption de l’intestin grêle augmentent avec l’âge.
Grâce à son relief, on peut ainsi estimer que la surface de la muqueuse intestinale, si elle pouvait être complètement déployée, correspondrait à un terrain de tennis (250 – 400 m²). Cet énorme tissu se renouvelle rapidement (en 4-7 j), à partir d’une cellule-souche unique (“stem cell”), que l’on trouve au niveau des cryptes et qui se différencie en migrant vers le sommet des villosités. Les entérocytes sont polarisés, avec un pôle apical tourné vers le contenu luminal, et un pôle baso-latéral.
B. LES MECANISMES GENERAUX DE L’ABSORPTION
L’intestin grêle est le siège de mouvements d’eau (solvant) et de substances dissoutes (solutés) ou en suspension (comme les graisses). Il existe des flux entrants correspondant à l’absorption, et des flux sortants correspondant à la sécrétion. Dans les conditions normales, la résultante de ces flux est nettement prédominante pour l’absorption. Cette absorption peut se faire par voie paracellulaire (entre les cellules) ou transcellulaire (en traversant les deux membranes de la cellule).
1. Digestion et absorption des nutriments
a. Digestion et absorption des glucides
Chez l’homme, l’ingestion d’hydrates de carbone (environ 200-300 g/) représente environ la moitié des apports caloriques. Celle-ci comprend surtout l’amidon alimentaire (55-65%), mais aussi des disaccharides comme le saccharose (20-30%) et le lactose, ainsi que des monosaccharides (glucose, fructose).
La digestion de l’amidon commence dans la bouche, sous l’action de l’amylase salivaire. La plus grande proportion est toutefois hydrolysée dans le duodénum sous l’action de l’amylase pancréatique. L’a-amylase libère ainsi du maltose, du maltotriose, et des dextrines contenant en moyenne 5 à 10 atomes de glucose.
Les oligosaccharides provenant de cette digestion, et les disaccharides, sont hydrolysés par des enzymes de la bordure en brosse (telles que la lactase) en glucose (80%), galactose et fructose.
Le glucose, le galactose et le fructose ne peuvent traverser la membrane de la bordure en brosse qu’après contact avec un système de transport spécifique.
b. Digestion et absorption des protéines
La ration quotidienne de protéines alimentaires varie de 70 à 100 g chez l’adulte. La masse de protéines qui entre dans la lumière intestinale comprend également les protéines endogènes, constituées des enzymes et glycoprotéines des sécrétions salivaires et bilio-digestives, ainsi que la desquamation cellulaire.
La digestion endoluminale des protides commence au niveau de l’estomac par l’action des pepsines qui clivent les protéines en peptides et peptones. Au niveau de l’intestin grêle, l’entérokinase, libérée par la bordure en brosse par les sels biliaires, transforme le trypsinogène en trypsine; celle-ci va alors activer les protéases pancréatiques. La digestion par les enzymes pancréatiques aboutit à la libération de 30 à 40% d’acides aminés et à la formation d’oligopeptides pour les 60-70% restants.
La digestion de ces oligopeptides va se poursuivre, sous l’action des nombreuses peptidases de la bordure en brosse, pour libérer au total 40% des acides aminés et former des di- et tripeptides pour les 60% restants.
Le transport des acides aminés et oligopeptides
L’épithélium intestinal possède des transporteurs spécifiques, utilisant des mécanismes différents, pour l’absorption des acides aminés et des di- ou tripeptides. Les oligopeptides absorbés sont hydrolysés dans l’entérocyte par des peptidases intracellulaires.
D’un point de vue clinique, la reconnaissance que des di- ou tripeptides peuvent être absorbés efficacement par des systèmes différents de ceux des acides aminés permet d’utiliser des oligopeptides, d’une part pour réduire la pression osmotique des solutions et aussi pour apporter des acides aminés peu solubles (tyrosine) ou peu stables (glutamine, cystéine).
C. DIGESTION ET ABSORPTION DES LIPIDES
Les lipides représentent 30-50% des calories ingérées avec des prises alimentaires correspondant à 60-100 g graisses/j, dont 90% sous forme de triglycérides et 10% sous forme de cholestérol, phospholipides et stérols végétaux. Une proportion importante de cholestérol et de phospholipides présents dans la lumière intestinale sont d’origine endogène, provenant de la sécrétion biliaire.
L’émulsification des graisses ingérées par la mastication, les contractions de l’antre et les sels biliaires (dérivés du cholestérol) produit des petits globules graisseux.
L’hydrolyse des triglycérides se poursuit par la lipase gastrique et aboutit à la formation d’un monoglycéride et de deux acides gras.
La solubilisation micellaire : les molécules lipidiques (triglycérides, monoglycérides, vitamines liposolubles, acides gras à chaîne longue, phospholipides, cholestérol) sont incorporées dans d’autres structures sphériques appelées micelles, dont le pôle extérieur hydrophile est constitué par les sels biliaires, se comportant comme des détergents en se disposant à l’interface lipide-eau.
La colipase sécrétée par le pancréas déplace les sels biliaires de surface et ancre la lipase aux molécules de triglycérides contenus dans les micelles, avec poursuite de l’hydrolyse et libération d’acides gras.
Les acides gras à chaîne longue sont transportés par les micelles vers la bordure en brosse de la cellule intestinale.
A l’intérieur de l’entérocyte, les monoglycérides et les acides gras à chaîne longue sont reconstitués en triglycérides et le cholestérol est estérifié. Les molécules lipidiques sont intégrées dans de nouvelles particules lipoprotéiques, les chylomicrons qui sont sécrétés dans les lymphatiques et finalement déversés dans le courant sanguin à partir du canal thoracique.
Les acides gras à chaîne moyenne (TCM) suivent un métabolisme différent : ils ne sont pas incorporés dans les micelles et traversent l’entérocyte sans reformer des triglycérides.
L’utilisation de TCM est intéressante dans des conditions où la quantité de lipase pancréatique ou la sécrétion biliaire sont diminués ou lorsque la fonction micellaire est entravée (pullulation microbienne qui déconjugue les sels biliaires).
Considérant que les lipides représentent la forme la plus concentrée d’énergie, on se rend compte de l’importance des problèmes liés à un défaut d’absorption (associés à une symptomatologie de stéatorrhée et entraînant rapidement une dénutrition calorique sévère et des carences en vitamines liposolubles et en acides gras essentiels). A l’inverse, si l’on tient compte de l’incidence élevée des hyperlipoprotéinémies, on comprend l’intérêt à pouvoir réduire l’absorption des lipides alimentaires. Deux des principales voies suivies pour atteindre ce but sont la mise au point d’inhibiteurs des lipases et le développement de substrats résistant à la digestion (polymères de sucrase ou “Olestra”).
1. Absorption des sels biliaires
Environ 95% des sels biliaires qui arrivent dans l’intestin sont réabsorbés, au niveau de l’iléon, pour regagner le foie par la circulation porte (cycle entérohépatique).
2. Absorption des principaux minéraux et des vitamines
Absorption du fer (Fe)
Seule une partie du fer alimentaire pénètre dans l’entérocyte. Le fer ferrique (Fe+++) est insoluble et non absorbable.
L’acidité gastrique, l’acide ascorbique favorisent l’absorption du fer en le maintenant sous forme de fer ferreux (Fe++).
Dans l’entérocyte, le fer est stocké ou transporté sous forme de ferritine jusqu’aux membranes baso-latérales où se trouvent les récepteurs de la transferrine. Libérée de la ferritine, le fer va se fixer sur l’apotransferrine pour fermer une molécule de transferrine saturée.
Une carence en fer, une lésion de la muqueuse duodénale ou jéjunale ou un état de dénutrition (via la réduction des protéines transporteuses) ou une perte digestive par saignement sont les causes les plus fréquentes de déficit en fer.
Dans l’hémochromatose, l’absence de régulation des facteurs entérocytaires, génétiquement déterminée, est à l’origine d’une absorption excessive de fer.
Absorption du calcium (Ca)
Les apports de Ca proviennent essentiellement du lait et de ses dérivés ainsi que des céréales.
L’absorption intestinale de Ca s’effectue par un processus passif et actif, ce dernier nécessitant une stimulation par la forme biologiquement active de la vitamine D : 1,5 (OH)2 vitamine D3 qui induit la formation intracellulaire d’une “Ca binding protein”.
Un déficit en vitamine D, en sels biliaires diminuent l’absorption de Ca de même que certaines substances présentes dans la lumière intestinale : oxalates, triglycérides à chaîne longue.
Absorption du zinc (Zn)
Elle a lieu également dans le jéjunum après liaison à un ligand.
Absorption des principales vitamines
hydrosolubles
Le folate de l’alimentation se présente sous forme libre et sous forme conjuguée (“polygluytamyl folate”). Cette forme conjuguée doit être hydrolysée en monomères avant l’absorption par la muqueuse intestinale, au niveau du jéjunum.
Une compétition pour le transport de folate est observée avec des analogues comme le méthotrexate et avec la sulfasalazine, agent utilisé dans le traitement des maladies inflammatoires de l’intestin.
La vitamine B12 est absorbée essentiellement au niveau de l’iléon, par un mécanisme actif. Cette absorption implique une glycoprotéine d’origine gastrique, le facteur intrinsèque, qui forme un complexe avec la vitamine B12. Le bicarbonate pancréatique et l’ion Ca++ fournissent les conditions nécessaires à la liaison du complexe à un récepteur iléal. La vitamine B12 est alors transportée de façon active dans la cellule muqueuse, tandis que le facteur intrinsèque est libéré et excrété.
De la cellule muqueuse, la vitamine B12 est transférée sur des protéines plasmatiques (transcobalamines) pour être délivrée aux tissus. Un manque de facteur intrinsèque (anémie pernicieuse, gastrectomie), une altération de la muqueuse iléale (maladie, résection, by-pass, irradiation, ...), mais aussi une consommation par une prolifération de bactéries dans la partie haute du grêle, entraînent une malabsorption de la vitamine B12.
Absorption des vitamines liposolubles
D’une façon générale, les vitamines liposolubles sont absorbées avec les graisses alimentaires et sont incorporées dans les chylomicrons.
La vitamine A est présente dans l’alimentation sous forme d’esters de rétinol (origine animale) ou de bêta-carotène (origine végétale). Les esters de rétinol sont hydrolysés en rétinol au niveau de la bordure en brosse ; le rétinol est absorbé passivement dans l’entérocyte où il est réestérifié (avec du plamitate) et incorporé dans les chylomicrons. Le bêta-carotène est partiellement hydrolysé en rétinol, et la fraction restante est aussi incorporée dans les chylomicrons.
La vitamine D est absorbée passivement dans les cellules muqueuses, de même que la vitamine E, dont l’absorption n’est pas très efficace.
La vitamine K présente la caractéristique d’être produite presque totalement par les bactéries de l’intestin humain.
Les états liés à la malabsorption des lipides entraînent, lorsqu’ils se prolongent, un déficit d’absorption des vitamines liposolubles.
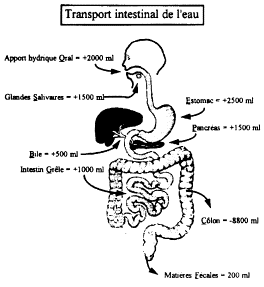
3. Transport de l’eau et des électrolytes (fig. 1, 2)
a. Absorption de l’eau
Le volume liquidien entrant dans l’intestin grêle est, en moyenne, de 9 l/j qui correspondent aux liquides ingérés (2 l/j) et aux sécrétions endogènes salivaire, gastrique et bilio-pancréatique (7 l/j). Le côlon (droit surtout) va absorber la grande majorité de cette eau, les pertes fécales étant de 100 à 200 ml/j (Figure 1).
Le transport d’eau à travers la muqueuse intestinale est un processus complètement passif et est étroitement couplée à l’absorption des solutés.
b. Absorption des électrolytes
Au niveau du jéjunum, l’absorption du Na+ est couplée à celle des solutés (glucose, acides aminés, ...) ou par un système échangeur Na+/H+ et celle du Cl- est passive.
Au niveau de l’iléon et du côlon droit, Na+ et Cl- sont absorbés par deux systèmes échangeurs, Na+/H+ et Cl-/HCO3-.
Le K+ est presque exclusivement absorbé par diffusion passive dans l’intestin grêle. Un processus de sécrétion de Na+ et Cl existe également au niveau des cryptes par l’intermédiaire de messagers intracellulaires (AMPc, GMPc, ...).
 La
résultante est en faveur de l’absorption.
La
résultante est en faveur de l’absorption.
|
Résumé Apport oral : O
Sécrétions
endognènes = S+E+B+P+G : Apport global = O+S+E+B+C+G : Absorption
= C : %
absorption = 8800/9000 : |
2000 ml 7000 ml 9000 ml 8800 ml 98 % |
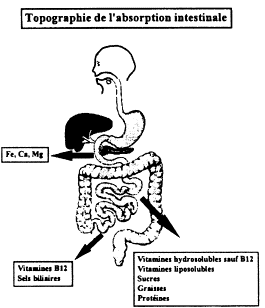
Fig. 1. Transport intestinal de l’eau Fig. 2. Topographie de l’absorption intestinale
II. MANIFESTATIONS CLINIQUES
Les symptômes suggestifs d’une pathologie de l’intestin grêle sont ceux liés à une malabsorption et à des troubles de la motilité.
La malabsorption provoque une diarrhée, une perte de poids, une distension abdominale et des carences en vitamines et en oligo-éléments.
Les troubles de la motricité intestinale peuvent être responsables de distension abdominale, de douleurs postprandiales, de nausées, de vomissements ou de diarrhée.
Les symptômes suggestifs d’une pathologie colo-rectale sont la douleur abdominale et des troubles du transit (diarrhée ou constipation).
Des hémorragies digestives peuvent se manifester tant dans les lésions grêles que coliques. D’une manière générale, les lésions grêle se manifestent par du mélaena, les hémorragies coliques par du sang rouge rutilant (hémochésie).
III. EXAMENS COMPLEMENTAIRES
A. IMAGERIE
La radiologie classique occupe une place importante dans ce type de pathologie. Elle comprend : l’abdomen sans préparation, le transit baryté (simple ou par entéroclyse) et le lavement baryté (en simple ou en double contraste).
L’échographie et la tomodensitométrie n’ont pas de place dans l’étude des lésions muqueuses, mais elles peuvent renseigner sur un épaississement ou une infiltration pariétale, une collection liquidienne, le développement d’une tumeur ou la présence d’adénopathies.
B. ENDOSCOPIE
L’endoscopie permet, en général, d’explorer le grêle supérieur, l’iléon terminal et tout le côlon.
La recto-coloscopie permet entre les mains d’un opérateur entraîné l’exploration du rectum de tout le côlon et de la dernière anse iléale dans plus de 90% des cas. L’examen nécessite un lavage du côlon. Celui-ci est réalisé par l’administration orale de laxatifs et de solutions hypertoniques dont la composition est calculée de manière à ne pas provoquer de mouvements internes d’eau ou d’électrolytes. La durée de l’examen est de 15 minutes à plus d’une heure selon les difficultés techniques rencontrées. La distension du côlon ou la traction sur les mésos peut entraîner des douleurs qui aux yeux de certains gastro-entérologues justifient une anesthésie générale. Il est toutefois préférable de pratiquer l’examen après administration de sédatifs et d’antispasmodiques car l’anesthésie générale peut masquer la survenue de complications. Outre l’apport diagnostique (aspect macroscopique, réalisation de biopsies et d’aspiration de liquide), la coloscopie a un intérêt thérapeutique : résection de polypes, électrocoagulation ou traitement par Laser de lésions hémorragiques ou tumorales, dilatation de sténoses, désinflation de certaines dilatations coliques.
Moyennant l’observance de règles strictes, les complications sont rares. Il s’agit de perforations et d’hémorragies survenant principalement après polypectomie. Il y a intérêt à maintenir le patient sous surveillance durant les heures suivant l’examen surtout après résection d’un gros polype. La coloscopie peut être à l’origine d’une bactériémie. Les malades atteints d’affections valvulaires cardiaques ou de prothèses courent le risque d’une compli-cation infectieuse qu’il faut prévenir par l’administration d’antibiotiques. Dans les colites graves, l’examen doit être prudent en raison du risque de dilatation toxique ou de perforation.
L’oesogastroduodénoscopie permet souvent l’exploration du grêle proximal.
L’entéroscopie réalisée au moyen d’un endoscope fin et long permet l’exploration du jéjunum et éventuellement de l’iléon à la recherche par exemple d’une hémorragie digestive occulte.
L’écho-endoscopie permet l’exploration de la paroi et de l’environnement rectal.
C. EXPLORATION FONCTIONNELLE
La scintigraphie au sulfure colloïdal permet d’observer la vidange gastrique et le remplissage colique et donc la mesure du temps de transit dans le grêle. Le temps duodéno-caecal est de 2 à 4 heures.
Le test respiratoire au lactulose mesure le temps de transit oro-caecal (cf. tests respiratoires). Le temps moyen est de 2 à 4 heures.
La mesure du temps de transit colique est réalisée par ingestion de 20 sphères radio-opaques (marqueurs). Leur progression dans l’intestin est suivie journellement par un cliché simple de l’abdomen. Celui-ci est divisé en trois secteurs : côlon droit, côlon gauche et côlon pelvien. Un relevé du nombre de marqueurs dans chaque secteur est effectué chaque jour. Cet examen permet d’objectiver l’existence d’une constipation et de préciser le type : par inertie ou par difficulté d’expulsion.
La défécographie
étudie la dynamique de l’évacuation du rectum par la prise de clichés
successifs au moment de l’évacuation d’un lavement opaque de même consistance
que celles de matières fécales. Les images de profil permettent d’objectiver le
défaut d’ouverture de l’angle recto-anal, ou la descente du plancher 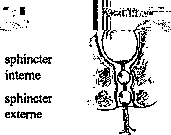 pelvien[1].
pelvien[1].
La manométrie rectale est réalisée au moyen d’une sonde à trois ballonnets munis de capteurs. Le premier est placé dans le rectum, le second au niveau du sphincter interne, le troisième au niveau du sphincter externe (fig. 3).
Fig. 3
L’examen comporte :
·
La mesure des pressions sphinctériennes au repos et au
cours d’un effort de contraction volontaire ou à la toux explore le sphincter
externe (voir figure 4).
Ces mesures sont utiles dans l’exploration d’une incontinence anale, de
certaines constipations et comme épreuve préopératoire chez les malades
candidats à une anastomose iléo-anale ou colo-anale.
·
L’analyse de la
présence du réflexe recto-anal inhibiteur (cf. figure 4). Une distension
rectale par une faible quantité d’eau ou d’air (50 ml) provoque une brève montée
de la pression de base suivie par une baisse de la pression en dessous du
niveau de base. Cette épreuve est utile pour le diagnostic de maladie de
Hirschprung.
·
L’analyse de la
compliance rectale (volume maximum tolérable) est utile dans le diagnostic du
mégarectum, des incontinences, dans certaines formes de côlon irritable et en
préopératoire chez les malades candidats à une anastomose colorectale. Le
volume normal toléré est d’environ 250 ml (fig. 4).
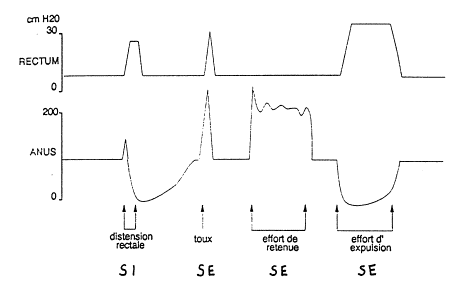
Fig. 4
D. BIOLOGIE CLINIQUE
|
EXAMEN HEMATOLOGIQUE |
Anémie microcytaire (¯ Fe) ou macrocytaire (¯ Ac Folique, ¯ Vit B12) |
|
TESTS INFLAMMATOIRES (VS, CRP) |
si diarrhée exsudative, néoplasie, inflammation |
|
IONS (Na, K,
Cl, Ca, P, Mg) |
¯ si déficit en ions |
|
TESTS ENDOCRINIENS Glycémie TSH Cholestérol |
Diabète Hypo ou hyperthyroïdie ¯ si malabsorption |
|
PHOSPHATASES ALCALINES Hépatiques Osseuses |
si cholostase si ostéomaladie |
|
FER |
¯ Si déficit en Fer ou inflammation |
|
TRANSFERRINE |
¯ Si inflammation Si carence en Fer |
|
PROTEINES + ELECTROPHORESE |
¯ Si malabsorption, maldigestion, diarrhée exsudative |
|
ACIDE FOLIQUE |
¯ Si malabsorption Si pullulation microbienne |
|
VITAMINE B12 |
¯ Si gastrite atrophique, gastrectomie totale, dysfonction iléale, maldigestion, pullulation microbienne |
|
TAUX DE PROTHROMBINE |
¯ Si malabsorption vit K (liposoluble) |
Le taux de C REACTIVE PROTEIN (CRP) est augmenté dans les inflammations (y compris les infections) et les néoplasies. Par rapport à la VS, la mesure du CRP est moins sensible, mais plus spécifique d’une inflammation et à une durée de vie plus courte.
|
CAROTENE, VIT A, VIT D |
¯ Si malabsorption des vitamines liposolubles ou malnutrition |
|
DOSAGES HORMONAUX SANG : gastrine,
VIP, PP, thyrocalcitonine, sérotonine, glucagon URINES : 5 HIAA |
Si tumeur endocrine sécrétoire Syndrome carcinoïde |
5 HIAA
L’acide 5 hydroxyindolacétique est un métabolite urinaire de la sérotonine qui est l’un des peptides vasoactifs libérés par certaines tumeurs carcinoïdes. Ce test est préféré au dosage de la sérotonine plasmatique étant donné la métabolisation rapide de la sérotonine sanguine.
|
SANG OCCULTE |
Hémorragie occulte |
|
SOUDAN III (Coloration des globules de graisse) |
+ Si stéatorrhée Faux + : prise d’huile de paraffine, suppositoires Faux - : stéatorrhée modérée |
|
PH |
< 6 : malabsorption des hydrates de carbone |
|
LEUCOCYTES |
Si diarrhée infectieuse ou inflammatoire |
|
OEUFS, PARASITES, CULTURE |
+ Si diarrhée infectieuse ou parasitaire |
SANG OCCULTE DANS LES SELLES SUR ECHANTILLON
La recherche de sang occulte dans les selles est utilisée pour le dépistage des lésions hémorragiques du tube digestif et notamment pour la détection précoce des tumeurs du côlon.
Différentes méthodes sont disponibles.
a) Activité peroxydasique de l’hémoglobine (HémocultÒ)
Le test est basé sur la conversion par oxydation d’un composant incolore en un dérivé coloré en présence de l’activité peroxydasique de l’hémoglobine. Il ne détecte en principe ni l’hémoglobine digérée ni les globules rouges (hémorroïdes).
C’est une méthode facile d’utilisation : les selles sont déposées sur une plaquette en carton contenant les réactifs et la réaction est lue quelques minutes plus tard.
Il y a beaucoup de faux positifs : activité peroxydasique de la viande rouge, du fer, des légumes non cuits et de faux négatifs : selles sèches, hémoglobine dégradée, vieillissement, saignement haut situé.
b) Fluorescence des porphyrines (HémoquantÒ)
Il y a également des faux positifs (hémoglobine de la viande rouge) mais il y a moins de faux négatifs, car la dégradation réduit l’hémoglobine en porphyrines.
En pratique ce test n’est pas plus performant que l’Hémocult.
c) Mesure de l’hémoglobine humaine par une méthode radioimmunologique
Il n’y a pas d’interférence avec la viande rouge mais la dégradation de l’hémoglobine donne une interférence négative. Cette méthode chère est à l’étude.
Conclusion : à l’heure actuelle, c’est la méthode à la
peroxydase qui est la plus recommandée. Il faut conseiller dans les jours qui
précèdent le test d’éviter les viandes rouges, les légumes non cuits, le fer,
la vitamine C et l’aspirine. Il est conseillé de répéter le test deux à trois
fois.
Méthode au SOUDAN III : Recherche de graisses sur échantillon de selles
On colore les gouttelettes de graisses par un colorant (Soudan III).
C’est un test simple servant au dépistage. Il est fiable pour les stéatorrhées modérées ou sévères, mais pas pour les stéatorrhées peu importantes.
|
POIDS |
> 300 g = diarrhée vraie |
|
TROU OSMOTIQUE |
> 100 mosm/kg = diarrhée osmotique < 50 mosm/kg = diarrhée sécrétoire |
|
Na FECAL |
> 90 mEq/l = diarrhée sécrétoire < 60 mEq/l = diarrhée osmotique |
|
CLAIRANCE a1 ANTITRYPSINE |
> 15 ml/24 heures = diarrhée exsudative |
|
ANALYSE QUANTITATIVE DES GRAISSES |
> 7 g/24 h : stéatorrhée (en cas de diarrhée sévère sans malabsorption la teneur en graisses peut s’élever de 7 à 14 G/24H) |
TROU OSMOTIQUE
Il est défini par la différence entre l’osmolalité théorique de 300 mosm/kg et le produit [Na + K] x 2. Sa valeur normale est située entre 50 et 100.
La présence dans les selles d’un soluté osmotiquement actif (sucres non résorbés, acides gras à chaîne courte, Mg, SO4, PO3) ne modifie pas l’osmolalité totale mais fait diminuer les concentrations de Na et de K augmentant la valeur du trou osmotique.
CLAIRANCE DE L’a1 ANTITRYPSINE
L’a1 antitrypsine est une protéine endogène qui n’est ni sécrétée ni réabsorbée ni dégradée dans le tube digestif. La mesure de la clairance fécale de l’a1 antitrypsine nécessite un dosage sanguin et fécal sur les selles de 24 heures. Les résultats sont exprimés en clairance plasmatique, c’est-à-dire en ml d’équivalent plasma perdu par jour.
C’est un bon marqueur
des entéropathies exsudatives mais il n’investigue pas les gastropahies
exsudatives de type Ménétrier.
ANALYSE QUANTITATIVE DES GRAISSES FECALES
L’analyse quantitative des graisses doit obligatoirement être réalisée sur les selles de 24 heures. Il est indispensable que le sujet ait, durant les 3 jours précédent le test, suivi un régime comportant ± 100 g de graisse par jour (il est stupide de faire l’analyse chez un sujet consommant un régime sans graisse !!!).
Les valeurs normales sont de ± 7 g/24 heures.
Ce test est indispensable pour confirmer la présence d’une stéatorrhée.
E. TESTS RESPIRATOIRES
|
14C-TRIOLEINE |
Stéatorrhée |
|
14C-XYLOSE |
Pullulation microbienne |
|
14C-CHOLYGLYCINE |
Pullulation microbienne et/ou malabsorption des sels biliaires |
|
LACTOSE H2 |
Déficit en lactase |
La mesure de l’excrétion respiratoire du 14CO2 radiomarqué après administration orale d’un substrat radiomarqué et son métabolisme permet la mesure de l’absorption de ce substrat ou de ses produits de dégradation dans les heures suivant l’administration. Il faut tenir compte des interférences métaboliques d’origine non intestinales : diabète, obésité, affections hépatiques, affections pulmonaires.
1. Tests au 14CO2
a. Test au Xylose 14CO2 (durée : 2
heures)
Le xylose est normalement absorbé complètement dans l’intestin grêle puis éliminé tel quel dans les urines.
En cas de pullulation microbienne du grêle, il y a métabolisation du xylose par les bactéries et libération de 14CO2 qui sera exhalé endéans l’heure de l’ingestion.
b. Test au cholyl-glycine 14CO2
(durée : 6 heures)
Cet acide biliaire suit normalement le métabolisme entéro-hépatique avec absorption au niveau de l’iléon terminal donnant un pic tardif peu important de 14CO2.
En cas de pullulation microbienne anaérobie du grêle, il y a déconjugaison précoce et importante de l’acide biliaire et un pic précoce de 14CO2 dans l’air expiré.
En cas de transit accéléré et/ou d’atteinte de l’iléon terminal (maladie de Crohn, résection iléale), l’acide biliaire n’est pas absorbé au niveau de l’iléon et est déconjugué par les bactéries coliques donnant un pic tardif important de 14CO2 dans l’air expiré.
c. Test à la Trioléine 14CO2 (durée :
6 heures)
Les triglycérides sont normalement absorbés au niveau du grêle puis métabolisés et le 14CO2 rejoint l’air expiré.
En cas de malabsorption ou de maldigestion on assiste à une diminution de l’excrétion du 14CO2 dans l’air expiré.
2. Tests à l’hydrogène
L’hydrogène est normalement produit dans le caecum par la fermentation des hydrates de carbone par les bactéries coliques. Cet H2 traverse la paroi intestinale, passe dans le sang et est rejeté dans l’air expiré où il peut être détecté et quantifié. Il faut tenir compte du fait que certains sujets sont dépourvus de flore de fermentation (faux -). D’autre part, les antibiotiques modifient le système colique.
a. Lactose H2
En cas de déficit en lactase, le lactose malabsorbé arrive en grande quantité dans le côlon ce qui donnera un pic tardif d’H2.
Une pullulation microbienne du grêle ou un transit accéléré donnent un pic précoce de H2.
b. Glucose H2
En cas de pullulation microbienne du grêle, le glucose est fermenté précocement par les bactéries donnant un pic précoce d’H2.
c. Lactulose H2
Le lactulose est dégradé par la flore colique dans le caecum. L’apparition de H2 dans l’air expiré après administration orale de lactulose permet de mesurer le temps de transit oro-colique s’il n’y a pas de pullulation microbienne dans le grêle.
F. SCINTIGRAPHIES
Elles sont réalisées au moyen d’une gamma caméra après administration orale ou parentérale de substrats marqués au 99mTc.
|
SULFURE COLLOIDAL 99mTc |
Transit grêle (N = 160 min) |
|
GLOBULES ROUGES 99mTc |
Hémorragie digestive |
|
PERTECHNETATE 99mTc |
Diverticule de Meckel |
GLOBULES ROUGES 99mTc
On utilise des globules rouges du malade marqués in vitro.
Cette méthode permet de déceler des hémorragies actives dont le débit est de l’ordre de 0,05 ml/min, ce qui est 10 fois plus sensible que l’artériographie. Elle peut déceler des saignements intermittents sur 24 ou 48 heures.
PERTECHNETATE 99mTc
Cette scintigraphie est utilisée pour détecter la présence d’une muqueuse gastrique hétérotopique dans un diverticule de Meckel. Ces muqueuses hétérotopiques peuvent provoquer l’apparition d’ulcères hémorragiques. Outre le diverticule de Meckel, l’estomac et les reins sont visualisés par l’examen.
IV. LA DIARRHEE
La diarrhée est la conséquence de troubles du transport intestinal de l’eau et des électrolytes. Elle implique une modification de la fréquence (> 3 selles/jour) et de la consistance des émissions (liquides ou abondantes). Le concept de la diarrhée vraie implique une teneur en eau élevée (> 80% du poids fécal) et un poids élevé (> 300 g/24 h).
Deux troubles physiopathologiques majeurs peuvent être impliqués (parfois simultanément):
|
|
Exemples |
|
INHIBITION DE L’ABSORPTION DE NaCl |
Entérotoxines, Escherichia coli |
|
PRESENCE INTRALUMINALE DE SUBSTANCES OSMOTIQUEMENT ACTIVES (DIARRHEE OSMOTIQUE) |
Lactose : déficit en lactase Sorbitol : chewing-gum Lactulose (laxatif osmotique) Mg (laxatif) |
|
AUGMENTATION DE LA VITESSE DU TRANSIT INTESTINAL (DIARRHEE MOTRICE) |
Côlon irritable Résection de la valvule de Bauhin |
|
|
Exemples |
|
PAR STIMULATION DE LA
SECRETION DES ANIONS (Cl, HCO3) DIARRHEE
SECRETOIRE |
Stimulus exogène : choléra Stimulus endogène : tumeurs à VIP, acides gras hydroxylés (stéatorrhée), médiateurs inflammatoires, hyperplasie des cryptes (maladie coeliaque) |
Plusieurs classifications cliniques de la diarrhée ont été proposées. Nous retiendrons celle basée sur le mécanisme physiopathologique responsable, tout en insistant sur le fait qu’une même affection peut entraîner de la diarrhée par divers mécanismes en même temps.
|
SANS STEATORRHEE |
AVEC STEATORRHEE |
|
1. Osmotiques Causes exogènes Causes endogènes 2. Sécrétoires Causes exogènes Causes endogènes 3. Motrices 4. Exsudatives |
1. Malabsorption 2. Maldigestion a. Pancréatique b. Biliaire |
A. DIARRHEES SANS STEATORRHEE
1. Diarrhées osmotiques
Ces diarrhées sont dues à la présence dans l’intestin de substances à pouvoir osmotique élevé créant un appel osmotique d’eau et d’électrolytes. L’augmentation de l’osmolarité fécale augmente le débit liquidien intraluminal. Elles peuvent résulter d’une surcharge orale (médicaments, aliments) ou de l’absence de digestion de disaccharides.
La diarrhée osmotique donne des selles abondantes, jaunâtres, parfois mousseuses. Dans les selles le trou osmotique est élevé (> 100 mosm/kg) et le Na fécal est faible (< 60 mEq/l).
a. Causes exogènes
¨ Laxatifs osmotiques :
* Sulfate de Na et de Mg (sel AndrewsÒ)
* Phosphate de Na (fleet phosphoseeda®.
* Lactulose et lactitol (DuphalacÒ, BifitéralÒ, ImportalÒ, PortolacÒ)
¨ Magnésium :
· Antiacides (oxyde ou hydroxyde Mg)
* Produits diététiques enrichis en Mg.
¨ Aliments :
* Chewing-gum, sorbitol, fructose.
b. Causes endogènes : déficits en
disaccharidases
¨ Carence en lactase ® excès d’hydrates de carbone
¨ Excès d’acides gras à courte chaîne.
2. Diarrhées sécrétoires
La diarrhée sécrétoire est due à un défaut de transfert membranaire d’eau et d’électrolytes. Elle est abondante (souvent > 1.000 g/j), persiste à jeun et peut être accompagnée d’hypokaliémie avec tubulopathie hypokaliémique, acidose, métabolique et insuffisance rénale fonctionnelle. Dans les selles le Na fécal est élevé (> 90 mEq/l) et le trou osmotique est faible (< 50 mosm/kg).
a. Causes exogènes
¨ Laxatifs “irritants” : anthraquinones (Sennosides : ManceauÒ*, PrunasineÒ, SenokotÒ, AgiolaxÒ) et dantrone (Fructine VichyÒ) ; phénolphtaleïne (AgarolÒ, BoldolaxineÒ), Bisacodyl (DulcolaxÒ, SoftèneÒ); Aloes (pilules CarterÒ, grains de ValsÒ).
¨ Médicaments : colchicine, biguanides, digitaline, prostaglandines (MisoprostolÒ), sels d’or.
¨ Toxiques : alcool, caféine, organophosphorés, arsenic.
¨ Toxines bactériennes : Staphylocoque doré, Clostridium perfringens, Choléra ; E. coli toxogénique, Campylobacter jéjuni, Klebsiella, Yersinia.
b. Causes endogènes
¨ Sels biliaires : malabsorption des sels biliaires par maladie iléale, résection iléale, post cholécystectomie.
¨ Tumeurs endocrines : Vipome, Zollinger Ellison, mastocytose systémique.
¨ Acides gras hydroxylés : stéatorrhée.
3. Diarrhées motrices
La diarrhée motrice est liée à une accélération du transit intestinal avec défaut d’absorption d’ions et d’eau en raison d’un temps de contact insuffisant entre la muqueuse et le contenu intraluminal.
Cliniquement, elle se manifeste par des selles impérieuses, souvent post prandiales avec présence d’aliments ingérés le jour même, de volume faible (< 500 ml/j). Il existe une accélération du transit oro ou duodéno caecal. Cette diarrhée répond aux ralentisseurs du transit.
Dans certains cas, une hypomotilité est responsable de la diarrhée via une pullulation microbienne avec stéatorrhée.
Les principales causes sont :
¨ L’alcool.
¨ Les lésions endocriniennes: hyperthyroïdie, syndrome carcinoïde.
¨ Les lésions neurologiques : sympathectomie lombaire, vagotomie tronculaire ou sélective, Neuropathies diabétique ou amyloïde, Affections médullo-encéphaliques diverses.
¨ Lésions organiques ou fonctionnelles du tube digestif : côlon irritable, gastrectomie, résection iléo-colique by-pass, fistules (duodéno-coliques), post-cholécystectomie.
4. Diarrhées exsudatives
La diarrhée exsudative est caractérisée par une exsudation intraluminale de protéines avec hypoprotéinémie (albumine et gammaglobulines) avec ou sans œdème ou anasarque. Il peut y avoir perte de sang et de mucus et de la température. Les tests inflammatoires sont souvent positifs et la clairance en a1 antitrypsine élevée.
La diarrhée exsudative relève de plusieurs mécanismes physiopathologiques :
¨ Une stimulation de la sécrétion et une inhibition de l’absorption de l’eau et des électrolytes par des médiateurs locaux inflammatoires ou immuns (composante sécrétoire).
¨ Une stimulation des fibres nerveuses avec accélération du transit (composante motrice).
¨ Une destruction de la muqueuse avec augmentation de perméabilité (transsudation).
¨ Une maldigestion et une malabsorption des nutriments.
Les principales causes de diarrhée exsudative sont : les lésions de la paroi du grêle (maladie de Crohn, maladie cœliaque, grêle radique), les lésions de la paroi colique (maladie de Crohn, rectocolite ulcéro-hémorragique) et les blocages lymphatiques ou veineux (lymphome, lymphangiectasie).
B. DIARRHEES AVEC STEATORRHEES
Les manifestations cliniques comportent :
¨ Une diarrhée de type stéatorrhée :
* Selles volumineuses, pâteuses, décolorées,
nauséabondes, flottantes.
* Poids des selles > 400 g/j.
* Parfois du ballonnement, mais pas de douleur.
¨ Un syndrome carentiel. Il existe un trouble de l’absorption des protides, glucides, lipides et des vitamines hydro ou liposolubles (cf. tableau).
Le mécanisme de la stéatorrhée est lié à un processus sécrétoire au niveau du côlon par les acides gras mal absorbés et hydroxylés par les bactéries. Ces derniers augmentent également l’activité motrice.
Les principales causes sont :
1. Anomalies de la phase intra-luminale = maldigestion
Il s’agit d’anomalies de l’hydrolyse des nutriments.
a. Insuffisance pancréatique exocrine (ex. :
pancréatite chronique).
Lorsque le débit d’enzymes tombe en dessous de 10% de sa valeur normale, la maldigestion apparaît.
b. Insuffisance des sels biliaires
® Concentration des sels biliaires conjugués insuffisante par interruption du cycle entérohépatique.
· Cholestase : ex. : cirrhose biliaire
· Résection iléale étendue (> à 1 mètre) avec épuisement du pool des sels biliaires
® déconjugaison des sels biliaires
· pullulation microbienne : ex. : fistule duodénocolique.
2. Anomalies de la phase pariétale = malabsorption
La malabsorption peut être due à une affection réduisant le nombre (ex. : maladie cœliaque) ou la fonction des entérocytes (ex. : déficit en lactase), une infiltration de la lamina propria (ex. : maladie de Whipple, lymphome) ou un obstacle lymphatique et veineux (lymphome, lymphangiectasies, péricardite constrictive).
3. Anomalies de la phase de transport vasculaire des aliments = malabsorption
Elles concernent essentiellement les lymphatiques (ex. : lymphome).
|
Manifestation clinique |
Biologie |
Nutriment malabsorbé |
|
STEATORRHEE |
Ý Graisses fécales ß Carotène, cholestérol ß
Breath test Trioléine 14C |
Graisses |
|
DIARRHEE |
Ý Graisses fécales ÝTrou osmotique |
Acides gras hydroxylés (effet sécrétoire au niveau du côlon) Hydrates de carbone fermentés et acides gras à courte chaîne |
|
AMAIGRISSEMENT ASTHENIE |
Ý Graisses et azote fécal. ß Protéines sériques |
Graisses, prot., glucides |
|
ANEMIE FERRIPRIVE |
Anémie microcytaire ß Fe sérique |
Fer |
|
ANEMIE MEGALOBLASTIQUE |
Macrocytose ß Vit. B12, ß Ac. Folique |
Vit. B12, Ac. Folique |
|
PARESTHESIES, TETANIE |
ß Ca, Mg, K |
Ca, Vit. D, Mg, K |
|
DOULEURS OSSEUSES Ostéoporose, Ostéomalacie |
ß Ca, Vit. D Ý Phosphatases Alc osseuses |
Ca, Vit. D Protéines |
|
TENDANCE HEMORRAGIQUE |
ß PT |
Vit. K |
|
OEDEME, ASCITE |
ß Protéinémie Ý Clairance al AT |
Protéines |
|
DISTENSION ABDOMINALE |
Ý Liquide abdominal (Rx) ß PH fécal |
Eau H2, méthane |
|
GLOSSITE, STOMATITE |
ß Fe sérique, Ac. Folique, B12 |
Fe, vitamines B2, B3, B12, acide folique |
|
NEUROPATHIE PERIPHERIQUE |
ß B12 |
Vit. B,
Thiamine |
V. LA CONSTIPATION
On admet l’existence d’une constipation quand il y a moins de 3 défécations par semaine avec ou sans difficulté d’évacuation.
Il y a deux types de constipation : les primaires (liées à une propulsion des selles au niveau du côlon insuffisante ou inefficace : retard de transit ou une difficulté d’expulsion) et les secondaires.
A. CONSTIPATION PRIMAIRE
1. Classification
a. La constipation hypotonique
Le transit colique est ralenti dans l’entièreté du côlon et l’activité motrice postprandiale est diminuée.
Les causes les plus fréquentes sont :
· Le côlon irritable dans sa forme hypotonique
· La colite aux laxatifs qui survient surtout chez les femmes présentant des troubles psychiques. Elle peut être accompagnée de mélanose colique découverte à l’endoscopie.
Parmi les causes rares on relève :
· La pseudo-obstruction intestinale idiopathique. Cette affection se caractérise par une myo ou neuropathie viscérale avec hypomotilité de l’œsophage, du grêle et du côlon.
b. La constipation spastique
Une activité motrice augmentée, mais non propulsive rétrécit la lumière du côlon descendant et du sigmoïde retardant les mouvements du contenu colique.
La cause la plus fréquente est le côlon irritable dans sa forme spastique.
c. La constipation terminale ou dyschézie
Le transit colique est normal jusqu’au rectum. Les selles s’accumulent dans celui-ci et s’évacuent lentement ou pas du tout. Plusieurs mécanismes, éventuellement coexistant, peuvent être impliqués.
La cause la plus fréquente est le syndrome du plancher pelvien spastique (SPPS) qui est dû à une absence de relaxation des muscles du plancher pelvien et du sphincter anal externe.
Parmi les causes plus rares, relevons :
¨ Les lésions médullaires. Les voies nerveuses tant afférentes qu’efférentes sont coupées entre le cortex et le rectum ce qui entraîne une perte de la sensation de distension et la formation de fécalomes.
¨ Le mégacôlon acquis ou mégarectum qui résulte d’un émoussement de la perception de la pression intrarectale avec parfois encoprésie c’est-à-dire émission involontaire de selles.
¨ La maladie de Hirschsprung ou mégacôlon congénital : cette maladie rare est caractérisée par une absence de cellules ganglionnaires dans les plexus myentériques du rectum et d’une partie du sigmoïde.
2. Manifestations cliniques
a. Constipation
hypotonique
¨ Selles rares (< 3/sem) et dures
¨ Pas de douleur.
b. Constipation spastique
¨ Selles petites, dures
¨ Douleurs abdominales.
c. Constipation terminale
¨ Troubles de l’évacuation des selles (qui peuvent être normales)
¨ Efforts défécatoires intenses et prolongés
¨ Sensation d’évacuation incomplète ou envie continue d’aller à selle.
B. LA CONSTIPATION SECONDAIRE
Les principales causes sont les suivantes :
¨ Médicaments
* Analgésiques
* Anticholinergiques, antispasmodiques
* Antidépresseurs
* Antiparkinsoniens
* Agents cationiques : fer, aluminium
(antiacides), calcium
* Opiacés
* Anticonvulsivants
* Anticalciques.
¨ Sténoses et tumeurs
* Sténose diverticulaire, ischémique, radique
* Tumeurs obstructives du côlon et du rectum.
¨ Troubles neurologiques périphériques
* Neurofibromatose
* Neuropathie autonome
¨ Troubles neurologiques centraux
* Sclérose en plaque
* Parkinson
* Accidents vasculaires cérébraux
¨ Autres
* Diabète
* Hypothyroïdie
* Hypercalcémie, hypokaliémie
* Porphyrie
* Sclérodermie
* Amyloïdose
* Alitements et immobilisations prolongés.
CHAPITRE II : LES MALABSORPTIONS
I. LA MALADIE COELIAQUE
Elle est définie par des lésions histologiques du grêle proximal et par une réponse au régime sans gluten.
1. Anatomopathologie
La maladie atteint la muqueuse mais respecte les autres tuniques de la paroi. Les lésions sont maximales dans la région duodéno-jéjunale.
L’histologie comporte les éléments suivants :
· Une atrophie villisitaire partielle ou totale.
· Une hyperplasie des cryptes qui peut être très importante si bien que malgré l’atrophie villositaire l’épaisseur de la muqueuse est conservée.
· Une infiltration du chorion par des mononucléaires et des polynucléaires.
· Une augmentation du nombre de lymphocytes intraépithéliaux.
2. Pathogénie
Deux facteurs interviennent :
· Un facteur génétique : 15% des parents du premier degré sont touchés et il existe une fréquence élevée de certains antigènes HLA.
· Un facteur d’environnement de nature inconnue qui induit une réaction d’intolérance au gluten. Le rôle pathogène de la gliadine est important.
3. Manifestations cliniques
Chez l’enfant, les symptômes apparaissent entre 6 et 12 mois et comportent une chute de la croissance, des selles abondantes et mastic et des troubles du comportement. Les symptômes s’atténuent durant l’adolescence et réapparaissent vers 30 ou 40 ans voire plus tard encore. La maladie peut être découverte à l'âge adulte.
Le tableau clinique comporte :
¨ Des signes digestifs :
§ Une diarrhée chronique, de type stéatorrhée (selles abondantes graisseuses) avec flatulence et douleurs abdominales.
§ Une asthénie et une perte de poids.
¨ Des signes carentiels :
§ Une anémie par malabsorption du fer, des folates et de la vitamine B12.
§ Des douleurs osseuses par malabsorption du calcium et de la vitamine D (ostéomalacie).
§ Des crises de tétanie par malnutrition et malabsorption du Mg et du Ca.
§ Une neuropathie périphérique par carence en vitamine B12, thiamine, riboflavine et pyridoxine.
¨ Des maladies associées :
§ Dermatite herpétiforme, colite lymphocytaire, diabète, thyroïdites.
4. Diagnostic
Les examens suivants seront réalisés :
¨ Examens biologiques (cf. tableau p 21).
¨ La recherche d’anticorps anti-endomysium et anti-gliadine. Si négative, une maladie cœliaque est peu probable.
¨ Une endoscopie duodénale montrant un aspect en mosaïque après coloration par le bleu de méthylène avec biopsies duodénales et grêles montrant les différentes altérations caractéristiques de la muqueuse décrites plus haut.
¨
Un transit grêle
montrant :
§
Une dilution et une
fragmentation de la baryte.
§
Une dilatation de la
lumière.
§ Une disparition des interplis valvulaires.
5. Complications
Les sujets atteints de la maladie cœliaque sont prédisposés aux tumeurs malignes. C’est le risque de lymphome grêle qui est dominant.
Des ulcérations duodéno-jéjuno-iléales diffuses ou une sprue collagène (épaisse bande de matériel hyalin éosinophile sous-épithéliale) peuvent survenir chez quelques malades.
6. Traitement
Un régime sans gluten sera prescrit. Le seigle, l’avoine, le blé, l’orge et le froment sont proscrits. Le maïs et le riz sont autorisés. Au début, le régime sera dépourvu de lactose. Les conseils d’une diététicienne doivent être demandés. Les principales carences sont corrigées.
Les troubles subjectifs disparaissent en quelques semaines, les tests d’absorption se normalisent en 3 à 6 mois et la réapparition des villosités se fait après un an.
Le régime doit être maintenu à vie pour éviter le développement de lymphomes.
Certains malades ne répondent pas au traitement. Il existe 4 causes à cet échec :
¨ Le non-respect du régime.
¨ Une maladie réfractaire qui sera traitée par des corticoïdes.
¨ Le développement d’un lymphome.
¨ La présence d’une autre cause d’atrophie villositaire (cf. tableau).
|
¨ Maladie cœliaque. ¨ Déficit en immunoglobulines. ¨ Sprue tropicale. ¨ Parasites : Lamblia, Strongyloïdes. ¨ Diabète. ¨ Radiothérapie. ¨ Médicaments : antimitotiques, alcool, laxatifs, néomycine. |
II. LA PULLULATION MICROBIENNE DU GRELE
1. Pathogénie
Elle est liée à l’implantation dans le grêle proximal d’une flore microbienne saprophyte excessive.
|
ß |
||
|
Catabolisme bactérien de nutriments: acides aminés vit. B12 ß Anémie macrocytaire |
Hydroxylation des acides gras ß |
Déconjugaison des sels biliaires ß Stéatorrhée |
|
Il peut en outre exister une altération de l’épithélium de surface avec réduction de l’activité enzymatique de la bordure en brosse. |
||
2. Etiologie
|
I.
Prolifération
intragastrique · Achlorhydrie, antiH2, Oméprazole. II.
Stagnation
intestinale grêle · Anatomique § Gastrectomie de type Billroth II (Polya) § Diverticules duodénaux ou grêles § Anses aveugles (anastomoses termino-latérales ou latérales) § Sténoses · Motrice § Neuropathie diabétique § Sclérodermie, amyloïdose § Médicaments (phénothiazines) III.
Communication anormale § Fistule duodénocolique |
3. Manifestations cliniques
Les symptômes de la pullulation microbienne du grêle sont : une diarrhée avec stéatorrhée, une anémie mégaloblastique et une hypoprotéinémie.
4. Diagnostic
Le diagnostic se fait essentiellement par des tests respiratoires :
§ *C-Xylose
§ Cholyl-*C glycine
§ Tests à l’H2 (glucose).
Un transit baryté suffit en général pour déterminer la cause de l’affection.
5. Traitement
Le premier traitement à envisager est la suppression de la cause de la pullulation.
Lorsque cette suppression n’est pas possible, on prescrira des antibiotiques (AugmentinÒ, VibramycineÒ, FlagylÒ). Ces cures seront éventuellement répétées. Les triglycérides à chaîne moyenne sont utiles en cas de stéatorrhée.
III. LE “GRELE COURT”
Les répercussions
fonctionnelles des résections intestinales dépendent de la nature jéjunale ou
iléale de la résection, de l’étendue de la résection et de la suppression de
l’angle duodéno-jéjunal ou de la valvule iléo-caecale.
1. Les résections courtes
La résection courte du jéjunum est parfaitement tolérée. Par contre la résection d’un court segment de l’iléon donne lieu à une diarrhée surtout si la résection porte sur la valvule iléo-caecale. Il s’agit d’une diarrhée aqueuse non graisseuse éventuellement accompagnée de crampes.
Le traitement se limite, en général, à l’administration de cholestyramine (QuestranÒ) et de lopéramide (ImmodiumÒ).
2. Les résections étendues
La résection étendue du jéjunum est asymptomatique pour autant que le grêle restant soit sain. Il peut exceptionnellement apparaître une anémie (ferriprive ou par manque de folates), une hypocalcémie et une hypomagnésémie.
La résection étendue de l’iléon (> à 1 mètre) provoque une diarrhée graisseuse et des hypovitaminoses. Des calculs rénaux ou biliaires peuvent se développer.
Le traitement est avant tout diététique : réduction des graisses alimentaires et éventuellement administration de triglycérides à chaîne moyenne, addition de carbonate de calcium, de fer, de magnésium, de zinc et de vitamines.
3. Les résections “massives”
Durant la période postopératoire immédiate, une diarrhée profuse se manifeste. Elle sera traitée par alimentation parentérale et administration d’antiH2.
Après une ou deux semaines commence une période d’adaptation qui durera plusieurs mois. On peut promouvoir l’hyperplasie du grêle restant en réintroduisant une alimentation orale. La reprise sera graduelle en débutant par l’administration d’un régime liquide facilement assimilable (acides aminés, oligopeptides, oligosaccharides).
A la phase chronique, le traitement dépend de la valeur fonctionnelle du grêle restant. Certains malades restent dépendants d’une alimentation parentérale qui peut éventuellement se faire à domicile. D’autres atteignent un équilibre calorique satisfaisant, mais présentent des carences nécessitant l’administration parentérale d’acides gras essentiels, de vitamines et d’oligo-éléments.
IV. LA DEFICIENCE EN LACTASE DE L’ADULTE
Les manifestations cliniques comportent de la diarrhée, et des ballonnements secondaires à la fermentation du lactose dans le côlon. Le pH des selles est acide. En présence de ces signes, le diagnostic de côlon irritable est parfois évoqué à tort.
La confirmation du diagnostic est apportée par le test respiratoire au lactose.
Le traitement est diététique : suppression des aliments riches en lactose.
V. ENTEROPATHIES ET DEFICITS EN IMMUNOGLOBULINES
Cette affection est rare.
Les deux affections le plus
souvent en cause sont un déficit en IgA (< 100 mg/l) ou une hypogammaglobulinémie.
Plusieurs mécanismes peuvent
intervenir dans la malabsorption : une atrophie villositaire, une lambliase et
une pullulation microbienne.
VI. LA MALADIE DE WHIPPLE
Cette affection est rare.
La maladie de Whipple est une
affection chronique caractérisée par une infiltration macrophagique des tissus,
le grêle étant l’organe le plus souvent atteint. Elle est due à un bacille non
identifié.
Le tableau clinique comporte
une malabsorption associée à un syndrome rhumatismal et à des polyadénopathies,
des atteintes pleurales et péritonéales, des troubles neurologiques et
endocardiques.
Des biopsies jéjunales
multiples ne montrent pas d’atrophie villositaire, mais la présence de
macrophages contenant des granules PAS positifs dans le chorion. Des bacilles sont mis en évidence en
microscopie électronique.
Le traitement consiste en une antibiothérapie à poursuivre durant 2 ans.
CHAPITRE III :
LES TROUBLES FONCTIONNELS DU COLON
I. LE COLON IRRITABLE
On désigne sous le terme de côlon irritable une série de troubles dont la traduction clinique polymorphe est essentiellement centrée sur la présence, l’alternance ou l’association de trois symptômes majeurs : douleur, diarrhée, constipation.
De très nombreux noms désignent cette maladie difficile à cerner : colopathie fonctionnelle, colite hyperspasmodique, colopathie muco-membraneuse, etc.
La fréquence de cette affection est considérable : elle représente 50% des consultants en gastro-entérologie.
1. Physiopathologie
De multiples facteurs interviennent :
a. Des troubles moteurs
On observe, chez certains malades, une hypermotilité colique après le repas ou un stress. Chez certains malades, le transit oro-caecal et global est accéléré ce qui entraîne de la diarrhée. Chez d’autres, le transit colique est ralenti ce qui provoque une constipation.
b. Une perception viscérale anormale
Le seuil de perception à la distension colique (par des gaz ou des selles) est diminué ce qui explique probablement l’inconfort et les douleurs.
c. Des facteurs psychologiques
Des troubles tels l’anxiété, les phobies, les paranoïas et les somatisations sont fréquentes. Il est possible que ces troubles induisent des modifications de la motricité colique.
2. Manifestations cliniques
L’affection prédomine chez la femme (2 femmes pour 1 homme). Elle survient à n’importe quel âge, souvent avant 30 ans.
Les symptômes apparaissent souvent par “crises” quotidiennes, mensuelles ou annuelles. La symptomatologie a tendance à disparaître durant les vacances et à s’accentuer durant les périodes de stress.
La douleur est de forme, de localisation et d’intensité variable.
Les troubles du transit comportent de la diarrhée, de la constipation ou l’alternance des deux. La présence de mucus dans les selles est parfois rapportée.
D’autres “impressions” sont décrites : ballonnement abdominal, impression d’évacuation incomplète après défécation, etc.
Contrastant avec la richesse de la symptomatologie subjective, souvent décrite avec une abondance de détails, l’état général est parfaitement conservé et l’examen physique banal.
3. Diagnostic
Il n’y a aucun examen permettant le diagnostic. Des examens complémentaires (tests inflammatoires, tests de malabsorption, tests thyroïdiens, analyse des selles, lavement baryté ou coloscopie) sont indiqués pour éliminer une affection organique notamment lorsque l’histoire clinique est récente (< 6 mois), chez les malades de plus de 50 ans, en présence de rectorragies ou d’une histoire familiale de polype ou de cancer du côlon.
4. Traitement
La relation médecin-malade joue un rôle primordial.
L’alimentation sera équilibrée avec diminution ou suppression des irritants (tabac, café, alcool). On tiendra compte éventuellement d’une intolérance aux féculents et au lactose.
La constipation sera traitée en première ligne par des fibres, du psyllium, des mucilages, des laxatifs osmotiques, des prokinétiques (PrépulsidÒ) ou des argiles (MucipulgiteÒ).
La diarrhée sera traitée par des argiles (ActapulgiteÒ), du loperamide (ImmodiumÒ) ou de la cholestyranine (QuestranÒ).
Le syndrome douloureux sera traité par des antispasmodiques musculotropes et/ou des anticholinergiques ou par des séances de relaxation ou des antidépresseurs en deuxième ligne.
II. LA DYSYNERGIE ABDOMINO-PELVIENNE (SYNDROME DU PLANCHER PELVIEN SPASTIQUE)
La dysynergie du puborectal est due à une absence de relaxation des muscles du plancher pelvien (avec manque d’ouverture de l’angle ano-rectal) et du sphincter anal externe au moment de la défécation (figure 5).
Elle se caractérise par des efforts défécatoires inefficaces et prolongés. La maladie peut se compliquer de fissures anales et d’invagination sigmoïdo-rectale ou recto-anale qui détériorent un peu plus la vidange rectale ce qui aboutit à un cercle vicieux difficile à rompre.
Le diagnostic se fait par défécographie, manométrie anale (présence du réflexe recto-anal inhibiteur mais absence de la relaxation du sphincter externe lors du simulacre de défécation) (cf. figure 4).
Le seul traitement efficace est la rééducation par biofeedback (voir pathologie anale).
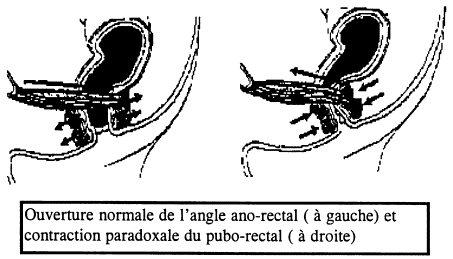
Fig. 5
III. LES MEGACOLONS
1. Les dysganglionoses
Le mégacôlon congénital (ou maladie de Hirschsprung) est la conséquence de l’absence de cellules ganglionnaires dans les plexus nerveux de Meissner et d’Auerbach. Elle s’étend depuis le sphincter anal externe sur un segment variable du côlon. Le segment aganglionnaire, en état de contraction permanente, est étroit et rigide. En amont, le côlon normalement innervé se distend de manière considérable d’où le nom de mégacôlon.
Dans la majorité des cas, la maladie de Hirschsprung se manifeste immédiatement après la naissance sous forme d’une subocclusion ou d’une occlusion complète.
De rares cas ne se manifestant qu’à l’âge adulte ont été rapportés. La symptomatologie comporte essentiellement de la constipation et des épisodes de subocclusion. Lorsque le segment ganglionnaire est très court, le rectum se dilate (mégarectum congénital).
Le diagnostic est posé par la radiographie, la manométrie ano-rénale (absence du réflexe recto-anal inhibiteur, qui consiste en un relâchement du sphincter anal interne lors de la distension d’un ballonnet intra-rectal) et l’histologie de la paroi rectale après prise de biopsies profondes.
A côté de l’agénésie des cellules ganglionnaires, existent plusieurs formes d’hyperplasie anarchique des plexus que l’on appelle : dysganglionoses.
Traitement chirurgical
Le traitement est standardisé dans l’aganglionose colique de l’enfant (parfois de l’adulte) ; il est décrit dans le cours de chirurgie pédiatrique.
Les cas de dysganglionoses sont extrêmement complexes à traiter. La première difficulté réside dans la géographie de la lésion.
Si la constipation touche le recto-sigmoïde, la colectomie subtotale ou totale est préconisée avec constitution d’un réservoir avec anastomose caeco-anale ou iléo-anale. Si le retard de transit ou les subocclusions sont pan coliques, certains auteurs préconisent l’iléo-anale, d’autres l’iléo-rectale.
Il faut en tout cas s’assurer de la motricité grêle et de l’absence de dysganglionose iléale.
2. Le mégacôlon acquis
a. Mégacôlon idiopathique de l’adulte jeune
Son origine est en rapport avec des accidents obstétricaux ou une constipation de longue date.
La dilatation porte surtout sur le rectum.
Il se manifeste par une constipation parfois accompagnée d’une émission involontaire de selles (encoprésie). Le rectum est dilaté et la compliance rectale est augmentée.
Avant d’accepter le diagnostic de mégacôlon idiopathique, il faut éliminer la présence d’une forme basse de la maladie d’Hirschsprung et des lésions nerveuses consécutives à un spina bifida.
Le traitement comporte la prescription d’un régime riche en fibres et de suppositoires ou de lavements. Une rééducation de l’évacuation intestinale et de la psychothérapie sont parfois nécessaires. On attachera une attention particulière à la détection et au traitement de lésions anales douloureuses.
b. Mégacôlon du vieillard
Chez des malades très âgés, on peut observer une constipation avec impaction fécale et incontinence.
Le rectum et parfois tout le côlon sont dilatés et inertes.
Cette affection est probablement due à une perte de la sensation de dilatation du rectum et une hypocontractilité du sphincter anal externe. Ces troubles peuvent résulter de la dégradation de l’état physique ou mental ou de lésions nerveuses loco-régionales.
Le traitement comporte essentiellement l’administration de lavements et l’évacuation manuelle des fécalomes.
IV. LE DOLICHOCOLON
Le dolichocôlon (allongement du côlon) est plus une constatation anatomique qu’une maladie. Il est exceptionnel qu’il soit responsable de symptômes et ne nécessite pas de traitement. Le raccourcissement chirurgical du côlon dans le but de faire disparaître une constipation tient de la plus haute fantaisie.
V. LA PSEUDO-OCCLUSION COLIQUE (SYNDROME D’OGILVIE)
On peut observer chez certains malades des signes d’occlusion colique alors que le lavement baryté et l’endoscopie ne révèlent aucune lésion ni sténose.
La pathogénie de cette pseudo-occlusion est mal connue. Elle semble favorisée par des affections neurologiques, des défaillances cardio-respiratoires et des états septiques, certains médicaments ou des troubles métaboliques. Curieusement cette maladie a tendance à se présenter d’une manière récidivante.
Le traitement est conservateur dans la forme modérée. Il sera endoscopique dans les formes graves et/ou lorsque le diamètre caecal est > à 12 cm (exsufflation du côlon et mise en place d’une sonde d’aspiration colique).
CHAPITRE IV :
LES ENTEROCOLITES INFLAMMATOIRES
IDIOPATHIQUES
On groupe sous cette dénomination deux affections d’évolution chronique et d’étiologie inconnue dont la présentation clinique et morphologique est nettement différente : la maladie de Crohn et la recto-colite ulcéro-hémorragique. Certains auteurs ajoutent à ces deux entités une “colite indéterminée” qui présente les caractères généraux des colites idiopathiques mais où l’ensemble des examens ne parvient pas à trancher entre rectolite et maladie de Crohn.
I. LA MALADIE DE CROHN
A. DEFINITION ET INCIDENCE
La maladie de Crohn est une affection relativement rare. L’incidence est de 5.4/105 à Bruxelles. Cette affection atteint préférentiellement la race blanche et les Juifs. La maladie débute à tout âge, surtout entre 20 et 40 ans.
B. ANATOMOPATHOLOGIE
1. Lésions macroscopiques (fig. 6)
Les lésions sont habituellement discontinues laissant entre les zones d’intestin malade de larges plages de muqueuse normale. L’affection est rapidement transmurale et entraîne un épaississement pariétal. L’anse entreprise est épaissie, rigide, souvent engainée dans un tissu fibrolipomateux ferme conduisant à une sténose. La muqueuse présente des épaississements focaux séparés par des zones d’ulcération réalisant une apparence en pavés. Les ulcérations sont au départ irrégulières (serpigineuses). Elles ont tendance à confluer pour donner naissance à de longues fissures longitudinales qui se développent en général sur le bord mésentérique.
Très souvent, la muqueuse au contact immédiat de la zone sténotique présente un aspect pathologique. Il s’agit alors de lésions de plus petite taille, plus superficielles que l’on pense être les stades de début de l’affection. Elles peuvent prendre une forme de petits nodules surélevés et ulcérés (nodules aphtoïdes) ou d’ulcérations irrégulières, serpigineuses, entourées de plis muqueux à disposition radiaire.
Les ulcérations profondes peuvent provoquer des abcès ou des fistules vers les organes voisins.
Les ganglions mésentériques sont presque toujours hypertrophiés, de consistance molle.
|
2 = Ulcères aphtoïdes 4 = Ulcères longitudinaux 5 = Relief en pavés 6 = Pseudopolypes 7 = Sténose 8 = Dilatation en amont 10 = Déformation caecale 11 = Iléite et sténose iléale 12 = Fistule 13 = Fistule anale |
Fig. 6 |
2. Lésions microscopiques
On note dans les lésions débutantes une hyperplasie des follicules lymphoïdes ainsi qu’un important épaississement de la sous-muqueuse dont les mailles sont distendues par un œdème protidique. Les vaisseaux lymphatiques sont dilatés. Au niveau muqueux, on observe un infiltrat mixte, variable, et plus rarement de petites formations granulomateuses.
Au début, les ulcérations sont peu profondes, on parle alors de fissures cryptiques. C’est au départ de telles fissures que se forment des trajets plus profonds, fistuleux, entraînant des adhérences avec les organes voisins.
Lorsque les lésions sont plus anciennes, la sous-muqueuse se fibrose ; elle est parsemée de petits nodules lymphoïdes. La muscularis mucosae est localement hyperplasique. Le tissu fibro-inflammatoire s’étend à toutes les couches de la paroi et infiltre le mésentère qui devient fibro-lipomateux.
Un des traits caractéristiques de l’affection, mais qui ne s’observe que dans 40% des cas environ, est le granulome tuberculoïde non caseïfiant,, formé de cellules épithéloïdes, de lymphocytes et de cellules géantes de type Langhans que l’on peut observer aussi bien dans la muqueuse que dans les autres couches de la paroi ainsi que dans les ganglions lymphatiques.
3. Localisation
La maladie atteint soit l’iléon, soit le côlon, soit les deux. L’atteinte iléo-colique est la plus fréquente (40-50% des cas). Viennent ensuite, les lésions iléales isolées (30 à 40%) et les lésions coliques isolées (10 à 20% des cas). On observe, mais plus rarement, des lésions dans le duodénum, et dans d’autres segments du tube digestif ainsi qu’au niveau de l’anus et de la bouche.
C. PATHOGENIE
Il est probable que la colite ulcéreuse et la maladie de Crohn soient des groupes hétérogènes de pathologies générant un même type d’atteinte tissulaire mais caractérisées par des troubles distincts de l’immuno-régulation.
La pathogénie est médiée par le système immunitaire (avec une prépondérance des médiateurs stimulants sur les médiateurs inhibiteurs) et modifiée par des facteurs génétiques (que suggèrent les regroupements ethniques et familiaux, la forte concordance entre jumeaux) et de l’environnement (flore intestinale, AINS, tabagisme). La colite ulcéreuse est surtout caractérisée par une immunité humorale perturbée avec présence fréquente d’auto-anticorps. La maladie de Crohn semble plutôt médiée par les lymphocytes T (CD4TH1).
D. MANIFESTATIONS CLINIQUES
La maladie est chronique, évoluant par poussées inflammatoires dont l’intensité et la fréquence varient d’un malade à l’autre. La rémission spontanée est possible.
Le tableau clinique est particulièrement varié et parfois peu spécifique.
Dans les formes iléales, il comporte de la douleur et de la diarrhée. La douleur est d’abord épisodique, souvent postprandiale, de localisation variable. Elle est néanmoins plus fréquente dans la fosse iliaque droite. Au début de l’évolution, elle peut céder spontanément durant de courtes durées pour réapparaître de plus en plus fréquemment et avec plus d’intensité. L’apparition de douleurs crampoïdes rappelant le syndrome de König, est suggestive d’une obstruction partielle secondaire à des processus sténosants. Le plus souvent, la douleur est associée à de la diarrhée dont l’importance varie en fonction de la gravité et de l’étendue des lésions. Un amaigrissement est fréquent et de la fièvre survient dans 30% des cas. Une dénutrition est observée dans les formes sévères. Elle est due au processus inflammatoire, à la diminution des ingesta, et, parfois, à une malabsorption (lorsque le jéjunum est entrepris ou lorsque les lésions intéressent plus d’un mètre d’iléon). Dans environ 25% des cas, une masse est palpée dans la fosse iliaque droite.
La forme colique se caractérise par des douleurs hypogastriques diffuses et crampoïdes et une diarrhée éventuellement sanglante. Elle est marquée par la grande fréquence de lésions anorectales : fissures, fistules et abcès péri-rectaux. Les lésions ano-rectales peuvent parfois être la première manifestation de la maladie.
Dans environ 10% des cas, le début de la maladie de Crohn est aigu et simule une appendicite aiguë. On relève des douleurs de la fosse iliaque droite, des signes d’irritation péritonéale et une pyrexie oscillant entre 37° et 38°. Dans les antécédents, on note souvent l’existence d’épisodes de diarrhée.
E. COMPLICATIONS
1. Intestinales
a. Fibrose et sténose
La fibrose cicatricielle s’ajoutant à l’inflammation et à l’œdème provoque un rétrécissement de la lumière intestinale. D’abord partielle, la sténose peut devenir complète. Une obstruction aiguë peut survenir lorsqu’une anse grêle est englobée dans un processus inflammatoire mésentérique ou péritonéal. Elle est souvent transitoire et peut céder à une aspiration gastro-jéjunale.
b. Fistulation et abcès
Cette complication est particulièrement fréquente. Outre les fistules anales, on peut observer des fistules internes (grêle-grêle, grêle-côlon, grêle-vessie) ou entérocutanées, principalement dans les formes iléocoliques. Les fistules entéro-entériques peuvent être responsables de phénomènes graves de dénutrition à cause de la malabsorption qu’elles peuvent entraîner.
c. Perforations
Les perforations en péritoine libre sont inhabituelles dans la maladie de Crohn.
d. Hémorragies
Des pertes de sang occulte peuvent contribuer à une anémie ferriprive. Dans les formes coliques, on peut observer du sang rouge dans les selles mais les hémorragies importantes sont rares.
e. Cancérisation
On observe des cancers de l’intestin (tant dans le grêle que dans le côlon) 3 fois plus souvent que dans une population exempte de la maladie.
2. Systémiques
a. Articulaires
Cette complication est la plus fréquente. Elle peut se présenter sous la forme d’arthrites migrantes, de sacro-iléite ou de spondylite ankylosante. Elle peut précéder la survenue de la maladie de Crohn et évoluer indépendamment d’elle.
b. Oculaires
Il s’agit soit d’iritis, soit d’uvéite.
c. Cutanées
On peut observer soit de l’érythème noueux, soit de la pyodermite gangreneuse.
d. Hépato-biliaires
La stéatose hépatique s’observe dans les formes associées à une dénutrition. La cholangite sclérosante, caractérisée par des lésions inflammatoires et fibrosantes des voies biliaires, est une complication relativement rare. Elle est responsable d’une cholostase. La lithiase biliaire est fréquente dans la maladie de Crohn, vraisemblablement à la suite de la réduction du pool d’acides biliaires mal réabsorbés à la suite des lésions de l’iléon terminal.
e. Rénales
Outre les effets néfastes sur la fonction rénale secondaires à l’infection des voies urinaires par les processus fistuleux, la fréquence de la lithiase rénale est plus grande que dans la population normale. Au même titre que dans d’autres causes de malabsorption, des calculs d’oxalate et une hyperoxalurie sont fréquents. La malabsorption des graisses provoque en effet une augmentation de l’absorption intestinale des oxalates alimentaires. L’amyloïdose est une complication grave mais rarement rencontrée. Elle doit être évoquée en présence d’une albuminurie importante.
F. DIAGNOSTIC
Le diagnostic de maladie de Crohn repose d’une part sur des éléments morphologiques et d’autre part sur l’exclusion d’une maladie grêle ou colique spécifique.
On utilisera différentes techniques d’imagerie : tomodensitométrie, lavement baryté et/ou un transit minuté du grêle, endoscopie avec prise de biopsies. La séquence des examens à réaliser dépend de la localisation probable de la lésion. Les images observées sont celles décrites en anatomopathologie.
Un examen coprologique et des examens sérologiques destinés à rechercher une infection spécifique, le plus souvent aiguë (salmonellose, shigellose, amibiase et particulièrement une yersiniose dont les lésions siègent à l’iléon terminal) seront réalisés.
Divers critères destinés à préciser quantitativement l’activité de la maladie ont été proposés sans qu’aucun d’entre eux ait réussi à s’imposer. On se base principalement sur les données cliniques (état général et nutritionnel, présence de douleurs, nombre de selles liquides par jour, présence d’une masse abdominale ou de complications) et des critères biologiques (V.S., CRP, albuminémie). Depuis peu, la coelioscopie avec biopsies intervient dans le diagnostic et l'évaluation des formes jéjuno-iléales notamment chez les sujets jeunes en poussée.
G. TRAITEMENT
1. Médical
a. Diététique et nutritionnel
Pendant les périodes quiescentes, il faut éviter les restrictions diététiques inappropriées car la maladie s'accompagne déjà de malnutrition protéino-calorique et de déficits en vitamines et en oligo-éléments. Un régime sans fibres est proposé lors des poussées inflammatoires ou en cas d'obstruction.
Durant les phases actives de la maladie, pour introduire un nombre de calories suffisant et pour mettre l'intestin au repos, on utilisera une alimentation entérale liquide. Celle-ci est composée d'acides aminés, d'oligopeptides et d'oligosaccharides. Ce type de régime améliore le bilan azoté, fait régresser les lésions et accélère la fermeture des fistules.
Dans les formes graves, une alimentation parentérale totale devient nécessaire. Cette thérapeutique est souvent temporaire, mais dans certains cas sélectionnés, il est justifié de la prolonger durant un ou plusieurs mois. Elle peut se faire en hospitalisation provisoire ou à domicile.
b. Pharmacologique
(1) Aminosalicylés
La Sulfasalazine (Salazopyrine7) est une association de sulfapyridine (sulfamide) et d'acide 5-aminosalicylique (5 ASA = mesalazine). La partie active (5 ASA) est libérée dans le côlon à la faveur de l'activité microbienne. Dans 15% des cas, il existe des effets secondaires, attribués à la sulfapyridine. La salazopyrine est principalement indiquée dans les atteintes coliques modérées et comme prévention des récidives après résection chirurgicale.
L'industrie pharmaceutique a élaboré des préparations de 5 ASA à dissociation entérique (formes orales ou locales) par procédé d'encapsulation qui sont utiles dans les formes de Crohn modérées et comme prévention des récidives après résection chirurgicale. Les effets secondaires sont plus rares qu'avec la sulfasalazine mais ils peuvent survenir (rash, pancréatite, hépatite, insuffisance rénale).
Les préparations de 5 ASA sous forme de suppositoires ou lavements sont indiquées dans les formes rectales ou sigmoïdiennes de la maladie.
(2) Corticostéroïdes
La prednisone est réservée aux formes sévères de la maladie et administrée par voie orale ou IV (1 mg/kg/j de prednisolone). Les doses sont diminuées progressivement en fonction de l'amélioration clinique et biologique.
Les effets secondaires sont le faciès lunaire (47%), l'acné (30%), les ecchymoses (17%), l'hypertension, la susceptibilité aux infections et la déminéralisation osseuse.
Le budesonide est un corticoïde rapidement métabolisé par le foie et donnant donc moins d’effets secondaires. Son efficacité est équivalente à la prednisone pour les formes de Crohn iléo-coliques.
Les corticostéroïdes sont prescrits pour une période courte (3 mois) et jamais en traitement d’entretien.
(3) Immunosuppresseurs
L'azathioprine (Imuran7) est envisagée en cas de cortico-résistance et de cortico-dépendance, de formes fistulisantes et comme prévention des récidives après chirurgie. Le délai d'action est long (6 mois) et le traitement est souvent maintenu à vie.
Les effets secondaires de l=azathioprine sont :
- Relation directe (7,6%) : Pancréatite
Dépression médullaire
Réactions allergiques
Cholostase.
- Relation indirecte (7,4%) : Infections
Lymphome ?
La cyclosporine (Neoral7) peut être administré par voie intraveineuse pour une période courte en cas de Crohn cortico résistant ou fistulisant. Son action se manifeste rapidement (" 2 semaines).
Les effets secondaires de la cyclosporine sont la néphrotoxicité, l'hypertension artérielle et la susceptibilité aux infections.
La méthotrexate (Ledertrexate7) peut être administré en cas d'intolérance ou d'échec à l'azathioprine, par voie intra-musculaire. Le délai d'action est court (2 à 4 semaines).
Il convient toujours de tenir compte du rôle des problèmes psychologiques dans le déclenchement des poussées et d'adapter une attitude adéquate vis-à-vis du patient.
(4) Antibiotiques
Le metronidazole ou la ciprofloxacine sont efficaces dans les localisations ano-périnéales de la maladie de Crohn.
c. Endoscopique
Des dilatations au moyen de ballonnets peuvent être réalisées en cas de sténose courte et fibreuse sans signes d'activité de la maladie.
2. Chirurgical
Un traitement chirurgical sera proposé en cas d'échec du traitement médical et en présence de complications chroniques (fistules entéro-entériques ou entéro-vésicales, sténoses) ou aiguës (perforation).
§ Lésions limitées du grêle: résection grêle ou iléo-colique limitée avec rétablissement de continuïté en 1 temps.
§ Lésions grêles étendues: résections limitées avec ou sans stricturoplasties.
§ Lésions colorectales: colectomie partielle ou subtotale avec anastomose colorectale ou iléorectale. Si le rectum est fort atteint, on est parfois obligé de faire une proctectomie suivie d'une colostomie ou iléostomie définitive.
Plus de 50% des malades doivent être réopérés dans les 20 ans qui suivent le début de la maladie.
On distingue cinq tableaux chirurgicaux dans la maladie de Crohn. Quelque soit la complication à traiter, les lignes de conduite adoptées sont les suivantes:
1. Epargne du grêle et respect éventuel de la valvule de Bauhin et de l'appareil résistif anorectal.
2. Réduction des intrusions pariétales par des abcès mini-invasifs, percutanés ou coelioscopiques.
3. Sevrage de l'immunosuppression, en particulier de la corticothérapie en préopératoire.
4. Support nutritionnel et anti-infectieux si nécessaire.
Les formes suivantes sont traitées chirurgicalement (60% des malades):
a.
Les sténoses
Les sténoses iléales ou coliques sont fréquentes. Fibrosées et souvent engainées dans la périviscérite, elles ne répondent pas correctement aux dilatations pneumatiques endoscopiques dangereuses ou aux stricturoplasties chirurgicales.
On préconise la résection des lésions et les anastomoses larges (par exemple: latéro-latérales, …). La suture est réalisée en terrain macroscopiquement sain.
b. Les fistules
Les fistules entérocutanées, entéroentérales, entérovésicales ou gynécologiques constituent une bonne partie des malades référés au chirurgien.
Si la tendance reste à l'épargne du tube digestif, les résections doivent clairement emporter les segments malades. Ceux-ci sont aisément identifiés par les adénopathies caractéristiques, l'épaississement des mésos et les hémorragies sous-séreuses provoquées lors de la manipulation des anses.
c. Les formes périnéales
La présentation à prédominance colorectale reste la forme la plus dramatique. Il est rare de pouvoir conserver le rectum. En cas de fistules périnéales, l'amputation du rectum devient souvent incontournable. La stratégie consiste alors à respecter l'appareil sphinctérien pour reconstruire ultérieurement une fonction anorectale.
Si certains chirurgiens tentent la reconstruction iléo-anale dans des cas sélectionnés, l'immense majorité des chirurgiens considèrent que la maladie de Crohn rectale reste une contre-indication à l'anastomose iléo-anale.
d. Les transformations malignes
Le passé de Crohn et les sténoses chroniques symptomatiques rendent difficile l'identification d'un cancer. D'autant plus que le site de cancérisation est rarement observable par endoscopie. Le diagnostic tardif conduit alors à une résection à but carcinologique. Celle-ci reste souvent palliative.
e. Les abcès
Le drainage d'un abcès est indispensable pour permettre la décompression, l'évacuation d'un réservoir microbien et de soulager le malade. Le drainage peut se faire par voie percutanée (sous échographie ou CT scanner), par voie coelioscopique ou par voie laparotomique dans les formes les plus dramatiques. Aucune suture ou réanastomose n'est alors réalisée. On peut recourir à l'iléostomie ou à la colostomie.
Après une chirurgie, on conseille souvent de reprendre un traitement aux aminosalicylés pour diminuer le risque de récidive locale.
La récidive locale postopératoire est exceptionnelle si la chirurgie a été radicale.
Par contre, de nouvelles localisations apparaissent dans 20 à 25% des cas. Le pronostic est meilleur lorsque la chirurgie a été menée électivement après un bon contrôle médical de la maladie.
II. LA RECTO-COLITE ULCERO-HEMORRAGIQUE
A. DEFINITION ET INCIDENCE
La recto-colite ulcéro-hémorragique (RCUH) est une inflammation chronique de la muqueuse colique affectant principalement le rectum et le côlon gauche. Elle se caractérise par des phases de rémissions et d’exacerbations des symptômes. Elle débute, en général, entre 20 et 40 ans, avec une recrudescence au cours de la 5e décennie. Elle est plus fréquente dans les pays occidentaux. Son incidence est de 4,5/105 à Bruxelles.
B. ANATOMOPATHOLOGIE
Contrairement à la maladie de Crohn colique dont les lésions sont discontinues et segmentaires, la recto-colite ulcéro-hémorragique s’étend de manière continue à partir de la ligne pectinéale pour atteindre une portion plus ou moins étendue du rectum et du côlon. Le rectum est quasi toujours atteint. Les lésions atteignent le recto-sigmoïde dans 16% des cas, le côlon gauche dans 17% et la totalité du côlon dans 37% des cas. La RCUH ne déborde habituellement pas la valvule de Bauhin bien qu’il existe une possibilité d’extension aux derniers centimètres de l’iléon (iléite de reflux). Les lésions anales sont exceptionnelles.
La rectocolite évolue par poussées et rémissions. On distingue classiquement trois phases : la phase chronique active, la phase de résolution et la phase de rémission (colite quiescente). Le tableau anatomopathologique change donc au cours du temps.
1. Macroscopie
Quel que soit le stade de l’évolution, les lésions de la RCUH se limitent, en général, à la muqueuse et à la partie superficielle de la sous-muqueuse. Ceci explique le peu de modifications relevées au niveau de la séreuse et du mésentère et la rareté des sténoses et des fistules.
Au début de la maladie, la muqueuse est turgescente, d’aspect granulaire, parsemée de nombreux petits ulcères saignant au contact. Lorsque les phénomènes aigus rétrocèdent, les ulcères se réépithélialisent progressivement. Des polypes inflammatoires (pseudopolypes) peuvent se former à partir des îlots de muqueuse surplombant les ulcères en voie de cicatrisation.
Dans les formes chroniques affectant une partie importante du côlon, l’organe se raccourcit et les haustrations disparaissent.
Le mégacôlon toxique constitue une complication redoutable de la maladie. Un segment colique, en général le côlon transverse, se dilate de manière monstrueuse (pneu d’auto). Sa paroi amincie et hémorragique est fragilisée ce qui peut entraîner une surinfection et une perforation. Cette complication est produite par l’extension de l’inflammation, habituellement cantonnée à la muqueuse, aux couches profondes de la paroi.
2. Microscopie
L’aspect microscopique de la rectocolite ulcéro-hémorragique est relativement caractéristique et permet de déterminer le stade évolutif de l’affection en se basant sur un certain nombre de critères bien codifiés à savoir : l’architecture de la muqueuse, la structure des cryptes glandulaires et l’atteinte inflammatoire du chorion.
En phase chronique active, l’examen histologique révèle des cryptes hypocrines de conformation régulière. L’épithélium est pénétré par des polynucléaires neutrophiles qui s’accumulent dans les lumières glandulaires amenant la formation d’abcès cryptiques. La surface est souvent irrégulière, d’aspect pseudovillositaire. La lamina propria est hémorragique et l’inflammation du chorion, de type mixte, est distribuée de manière homogène. Elle s’étend sur toute la hauteur de la muqueuse.
Au fur et à mesure que l’on évolue vers la résolution, on observe une raréfaction des cryptes avec déformation des contours, bifidité et perte d’orientation. L’hypocrinie persiste. L’infiltration inflammatoire du chorion reste marquée, homogène, à prédominance d’éléments lymphoplasmocytaire. On peut voir apparaître des amas lymphoïdes au contact de la muscularis mucosae.
Au stade quiescent, les déformations cryptiques s’accentuent mais les cryptes deviennent normocrines et sont même éventuellement hypercrines. Au niveau du chorion, la congestion vasculaire caractéristique s’atténue. L’œdème persiste ainsi qu’un infiltrat lymphoplasmo-cytaire modéré. Le diagnostic différentiel avec la colite ischémique en voie de guérison est difficile.
La dysplasie et la transformation en adénocarcinome doivent être recherchées. Il n’est pas rare de découvrir des adénocarcinomes sur les pièces opératoires. Cette découverte histologique conditionne le traitement et le pronostic de la maladie.
C. PATHOGENIE (voir Maladie de Crohn)
D. MANIFESTATIONS CLINIQUES
Lorsque la maladie se limite au rectum, le patient ne signale que la présence de sang dans les selles, éventuellement associée à du ténesme, sans qu’il y ait nécessairement de la diarrhée. Dans ces conditions, si un examen rectoscopique n’est pas réalisé, on peut commettre l’erreur d’attribuer ce saignement à des hémorroïdes.
Lorsque le sigmoïde est également atteint, on note de la diarrhée, caractérisée principalement par l’émission de glaires sanglantes soit isolément, soit au cours de la défécation. Les activités des patients sont fréquemment interrompues par des besoins répétés de défécation n’aboutissant qu’à l’émission de petites quantités de selles, teintées de rouge.
Dans les lésions diffuses du côlon, la diarrhée mucosanglante est le symptôme prédominant. Une douleur de type crampoïde précède la défécation. Ces symptômes se superposent à ceux qui viennent d’être décrits dans la forme rectale. La vie sociale de ces malades devient rapidement misérable et des phénomènes dépressifs se manifestent, d’autant plus que des altérations de l’état général ne tardent pas à survenir : asthénie, fièvre, amaigrissement.
Au cours des rechutes, une extension des lésions du rectum vers le côlon descendant et, éventuellement, l’ensemble du côlon est observée.
E. DIAGNOSTIC
En dehors d’un examen coprologique, centré notamment sur la recherche de l’origine microbienne ou parasitaire d’une diarrhée sanglante, le diagnostic de la colite ulcéreuse repose sur l’endoscopie, le lavement baryté et l’histologie.
1. Endoscopie
La colonoscopie confirme le diagnostic et permet de préciser l’étendue des lésions. Elle est également utilisée pour surveiller l’évolution et notamment l’apparition d’une dysplasie ou d’un cancer.
La manifestation la plus fréquente est la simple hypérémie de la muqueuse qui saigne au contact de l’endoscopie. Il n’y a pas d’intervalle de muqueuse saine (lésions diffuses). Au cours des phases de sédation clinique, on n’observe jamais de restitution ad integrum de la muqueuse. Même si l’aspect macroscopique semble normal, la biopsie montre la persistance d’anomalies. Fréquemment d’ailleurs, la muqueuse apparaît dépolie et finement granuleuse.
Dans les formes les plus graves, des ulcérations sont observées ; il n’y a pas de muqueuse saine entre les ulcérations. Les formes chroniques et évoluant depuis longtemps, provoquent un rétrécissement tubulaire de la muqueuse qui a perdu toute souplesse. Des formations pseudo-polyploïdes peuvent se développer.
Il est indispensable de pratiquer, au cours de l’endoscopie, une recherche d’amibes (frottis d’une ulcération) et des biopsies, en vue d’exclure d’autres diagnostics (maladie de Crohn, schistosomiase, etc.).
2. Radiographie (fig. 7, 8)
Elle permet de poser un diagnostic et de préciser le degré d’extension des lésions dans de rares cas où l’endoscopie laisse subsister un doute.
Dans les formes légères et débutantes, le lavement baryté peut être normal. Les caractéristiques des images comportent une perte du liseré de sécurité, une réduction des haustrations et des ulcérations muqueuses superficielles se traduisant par des spicules ou des aspects en « bouton de chemise ». Dans les formes chroniques, on décrit également des pseudo-polypes, un raccourcissement du côlon, un manque de distensibilité du rectum et, éventuellement, des sténoses.
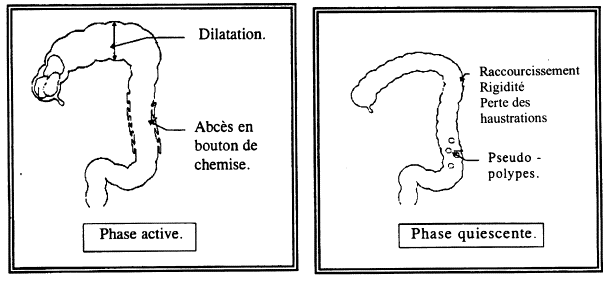
Fig. 7. Fig. 8.
3. Biologie
On observe un syndrome inflammatoire et une anémie dont l’importance dépend de l’étendue et de la gravité de la maladie.
Une coproculture doit être pratiquée à chaque poussée car il n’est pas rare qu’une surinfection se produise.
F. COMPLICATIONS
1. Locales
a. Hémorragies
3% des malades présentent des hémorragies massives. Des transfusions sanguines et, éventuellement, l’administration IV de cyclosporine constituent, en général, un traitement suffisant.
b. Mégacôlon toxique
Cette complication se manifeste habituellement par des signes généraux (collapsus vasculaire, confusion, état toxique) survenant brutalement en association avec une distension abdominale et une absence de péristaltisme. Elle peut être confondue avec une péritonite. Elle doit en être différenciée car le traitement du mégacôlon toxique est généralement médical.
Le diagnostic repose sur la radiographie de l’abdomen sans préparation qui montre une distension importante du côlon (supérieure à 6 cm) et une disparition des haustrations.
Le traitement comprend une réhydratation et la correction des troubles ioniques, des transfusions sanguines et une nutrition parentérale. L’évolution sera surveillée par la réalisation quotidienne d’un abdomen à blanc. Lorsqu’une amélioration n’est pas obtenue en quelques jours, une colectomie totale avec iléostomie s’impose.
c. Perforation
Dans 2 à 10% des cas, une péritonite se manifeste à la suite d’une perforation survenant soit spontanément, soit au cours d’une dilatation toxique du côlon. Les signes habituels peuvent en être masqués soit chez des sujets en mauvais état général, soit à cause d’un traitement aux corticoïdes. Le diagnostic sera suspecté en présence de pyrexie et d’une tachycardie insolite.
La radiographie de l’abdomen sans préparation montre un pneumopéritoine.
Un traitement chirurgical en urgence (colectomie et iléostomie) s’impose.
d. Cancer
Il est généralement précédé de dysplasie sévère.
Le risque dépend de la durée (> 10 ans) de la maladie et de son degré d’extension au côlon.
A Bruxelles, de 15 à 20 % des patients amenés à la chirurgie sont atteints d’un ou de plusieurs adénocarcinomes.
2. Systémiques
Les complications systémiques de la colite ulcéreuse sont pratiquement identiques à celles qui ont été décrites dans la maladie de Crohn, hormis les complications rénales, moins fréquentes.
G. TRAITEMENT
1. Médical
Le traitement médical de la colite ulcéreuse est similaire à celui de la maladie de Crohn.
La Salazopyrine7 est indiquée pour traiter une affection modérée. En cas d'effets secondaires, la mesalazine remplacera la Salazopyrine7. Dans la proctite ou procto-sigmoïdite ulcéreuse, les suppositoires ou les lavements à la Salazopyrine ou à la mesalazine sont aussi efficaces que les lavements à la cortisone. Dans les formes plus étendues le traitement sera administré par voie orale.
En période aiguë sévère, les corticoïdes sont le traitement de base. En cas de cortico-résistance la cyclosporine peut être administrée durant deux semaines après une discussion médico-chirurgicale.
Après rémission, l'administration de corticoïdes sera interrompue, mais un traitement d'entretien à la Salazopyrine ou au 5-ASA est indiqué car il diminue significativement la survenue de récidives.
2. Chirurgical
a. Indications
Le traitement chirurgical est indiqué dans 5 circonstances :
¨ Hémorragie sévère ne répondant pas au traitement médical;
¨ Mégacôlon toxique;
¨ Perforation;
¨ Affection réfractaire au traitement médical;
¨ Développement d'une dysplasie sévère ou d'un cancer colique.
b. Modalités thérapeutiques
Chirurgie élective
Comme dans toute pathologie digestive, les résultats et la morbidité sont largement bénéficiaires d’une programmation « à froid ». Le statut nutritionnel, volémique, psychologique et septique conditionnent le succès. En cas de rectocolite ulcéro-hémorragique réfractaire, le patient bénéficie d’une colonoscopie récente, voire d’une échoendoscopie rectale pour exclure un cancer invasif. La mise au point fonctionnelle comporte une manométrie ano-rectale et un testing fonctionnel.
Une prise en charge stomathérapique est programmée. Un sevrage cortico-thérapique est souhaité. L’intervention est réalisée après préparation colique stricte (Polyéthylène Glycol, antibiotiques oraux). L’intervention de choix est la proctocolectomie totale restauratrice (en 1 ou 2 temps) avec constitution d’un réservoir iléal (en J le plus souvent).
Après mucosectomie trans-anale, l’anastomose iléo-anale est réalisée à 1 ou 2 cm de la ligne pectinée. Le plus souvent, une iléostomie latérale de protection est réalisée et maintenue 2 mois.
En urgence
Dans un contexte de traitement médical aigu, une colectomie subtotale doit être proposée.
Le rectum est laissé en place, appareillé d’une sigmoïdostomie permettant l’irrigation locale. Une iléostomie terminale temporaire est réalisée. Trois à quatre mois plus tard, le deuxième temps est réalisé. Il consiste en la fermeture de l’iléostomie, une proctorectostomie restauratrice est faite. Un réservoir iléal est anastomosé au canal anal selon les mêmes modalités que supra. Le troisième temps consiste en la fermeture de l’iléostomie de protection après vérification de la fonctionnalité du montage.
Cancer
La découverte d’un cancer rectal pré- ou per opératoire change la stratégie. La priorité est dès lors carcinologique. Si la tumeur est colique (au dessus du cul-de-sac de Douglas), la proctocolectomie restauratrice en 2 temps est envisageable. Par contre, si le cancer est rectal, l’exérèse du rectum se fait selon les principes exposés dans le chapitre consacré au cancer rectal. Une lymphadenectomie et une résection mesorectale totale sont proposées (avec ou sans radio-chimiothérapie).
|
DIAGNOSTIC
DIFFERENTIEL |
|||
|
|
Colite
ulcéreuse |
Crohn colique |
Colite
ischémique |
|
Age |
Jeune - Avancé |
Jeune - Moyen |
Avancé |
|
Début |
Aigu ou progressif |
Aigu ou progressif |
Aigu |
|
Symptômes |
Pertes de sang et de mucus |
Diarrhée non sanglante Douleurs |
Douleurs Rectorragies |
|
Evolution |
Rechutes |
Rechutes |
Gangrène Rétrécissements Guérison |
|
Lésions anales |
Rares |
Fréquentes |
Aucune |
|
Rectum |
Toujours anomal |
Souvent normal |
Souvent normal |
|
Atteinte iléale |
Aucune |
Fréquente |
Aucune |
|
Fistules |
Rares |
Fréquentes |
Aucune |
|
Lésions à l’endoscopie ou au lavement baryté |
Continues Circonférentielles |
Discontinues Asymétriques |
Uni segmentaires Circonférentielles |
|
Biopsies |
Abcès cryptiques Distorsions glandulaires Inflammation diffuse et dans la muqueuse |
Atteinte segmentaire focale et transmurale Granulomes (40% des cas) |
Aspect en cité morte Déformations glandulaires |
|
Cancérisation au niveau du côlon |
Possible |
Rare |
Nulle |
CHAPITRE V :
LES ENTEROCOLITES INFLAMMATOIRES
NON IDIOPATHIQUES
I. LES ENTEROCOLITES INFECTIEUSES
A. ANATOMOPATHOLOGIE
On distingue trois formes d’atteinte infectieuse de l’intestin selon le mode d’action des germes (a) intervention d’une entérotoxine (b) action cytotoxique directe sur les cellules épithéliales du revêtement (c) invasion pariétale.
1. Action entérotoxique
a. Empoisonnement alimentaire
Les organismes contaminent les aliments où ils prolifèrent y entraînant l’accumulation d’entérotoxines dont l’ingestion provoque des troubles de la résorption du sel et des liquides. Il ne s’agit pas à proprement parler d’une infection mais plutôt d’une intoxication d’origine alimentaire. Les lésions histologiques produites sont minimes.
b. Infections se manifestant par l’action de
toxines
Les germes amenés par l’eau ou les aliments contaminés colonisent la surface de la muqueuse. Les lésions histologiques sont peu visibles.
Elles se manifestent par une diminution de la sécrétion de mucus, par des lésions des jonctions intercellulaires et par un certain degré d’œdème et de congestion de la muqueuse. La diarrhée résulte de pertes aqueuses liées à des troubles de la résorption de l’eau suite à la fixation des toxines sur des récepteurs localisés sur les entérocytes. Le modèle classique de ce type d’infection est le choléra qui provoque une déshydratation des patients par diarrhée incoercible.
2. Organismes cytopathologiques
Certaines souches d’Escherichia coli sont à l’origine de diarrhées aiguës surtout chez l’enfant. Les organismes adhèrent à la bordure en brosse provoquant des lésions de cette dernière et du cytosquelette des entérocytes. De nombreux virus (rotavirus, coronavirus) qui sont à l’origine de diarrhées épidémiques agissent par des mécanismes analogues ; certains peuvent provoquer la destruction d’une partie des entérocytes.
3. Organismes invasifs
Il s’agit ici de germes invasifs qui non seulement colonisent l’épithélium mais pénètrent la lamina propria et éventuellement les couches profondes et infiltrent les ganglions lymphatiques.
Dans les entérocolites infectieuses aiguës la muqueuse est granulaire, hémorragique et oedématiée. Elle saigne au moindre contact et présente des ulcérations serpigineuses. Bien que l’image histologique permette la distinction avec d’autres types d’entérocolites, elle n’a aucune spécificité quant au type de germe impliqué.
La muqueuse est oedématiée, parsemée de foyers inflammatoires riches en polynucléaires. Cet infiltrat prédomine en surface et épargne généralement la couche profonde de la muqueuse. Des abcès cryptiques peuvent se former, mais ils sont rares. Par contre, on observe fréquemment une pénétration de polynucléaires dans la paroi des cryptes.
B. ETIOLOGIE ET MANIFESTATIONS CLINIQUES
1. Bactériennes
a. Germes agissant uniquement par une
entérotoxine
¨ Choléra
¨ E. coli toxigénique (tourista)
¨ Staphylocoque doré (empoisonnement alimentaire)
¨ Clostridium perfringens (empoisonnement alimentaire : viandes).
Le seul symptôme digestif est une diarrhée aqueuse sans sang ni mucus pouvant être très importante avec peu ou pas de douleurs abdominales. L’évolution est bonne.
b. Germes invasifs et pénétrants
¨
Salmonelloses
¨
Shigelloses
¨
E.
coli pathogène
¨ Campylobacter jéjuni
¨ Yersinia
¨ Clostridium difficile
¨ Bacille de Koch
La diarrhée est accompagnée de douleurs abdominales et d’un syndrome inflammatoire qui peut être très important. La diarrhée est souvent muco-sanglante.
L’évolution peut être défavorable : choc septique, perforation, hémorragies abondantes, déshydratation, ...
Le clostridium difficile provoque une colite pseudo-membraneuse. Elle est caractérisée par le développement de membranes jaune verdâtres adhérentes à la muqueuse. D’un point de vue histologique, la muqueuse est le siège d’un infiltrat inflammatoire riche en polynucléaires. Les membranes superficielles sont formées d’un mélange de mucus, de fibrine et de pus. Cette affection, primitivement décrite dans le cadre des complications de traitements antibiotiques (initialement la clindamycine) est actuellement également classée parmi les affections nosocomiales. Le mode de transmission dans les institutions hospitalières reste imprécis. Il semble néanmoins probable que la contamination oro-fécale soit le mode de transmission le plus fréquent. Le diagnostic est basé sur la recherche de la toxine, dans les selles. L’aspect endoscopique est caractéristique (pseudo-membranes). Le traitement des formes sévères ou persistances comporte l’administration de métronidazole (4 x 250 mg/j/IV) ou de vancomycine per os (4 x 125 mg/j) durant 7 à 14 jours. Pour la prévention des récidives des diarrhées post-antibiotiques ou pour la prévention chez le sujet à risque, l’administration per os de saccharomyces boulardii (PérentérolÒ 2 x 500 mg/j) est utile.
La tuberculose intestinale est devenue très rare à cause de la
pasteurisation du lait et à cause de l’efficacité des traitements de la
tuberculose pulmonaire qui a pratiquement supprimé la contamination secondaire
de l’intestin. La localisation la plus habituelle est la région iléo-caecale.
Les lésions sont soit ulcérées, soit hyperplasiques; elles peuvent provoquer
des hémorragies, des perforations, des sténoses et des fistules. Le tableau
clinique au début de l’évolution est peu spécifique : amaigrissement, diarrhée
alternant avec de la constipation, douleurs de la F.I.D. Le diagnostic est basé
sur la présence d’un syndrome inflammatoire, l’examen anatomopathologique
(granulomes éventuellement calcifiés et bacilles acido-résistants) et la
microbiologie (examen direct et culture de biopsies prélevées au niveau des
lésions vues en iléo-coloscopie ou en laparoscopie). L’existence de lésions
associées pulmonaires, rénales ou osseuses est un indice important. Le
traitement est médical. La présence de complications peut représenter une
indication chirurgicale.
2. Virales
¨ Rotavirus, Virus de Norwalk, C.M.V., Herpes simplex
La diarrhée est accompagnée de douleurs abdominales et d’une hyperthermie plus ou moins importante. Des céphalées, des myalgies et une atteinte pharyngée font souvent partie du tableau clinique. Une lymphocytose peut être présente.
Les agents viraux n’entraînent pas de diarrhée invasive chez le sujet immunocompétent.
3. Parasitaires
¨ Lamblia
¨ Amibes
¨ Schistosomes
La lambliase se localise préférentiellement au duodéno-jéjunum. La diarrhée, lorsqu’elle est présente, peut s’accompagner de gêne épigastrique et de vomissements. Il peut exister une malabsorption.
L’expression clinique de l’amibiase est très variée : diarrhée glaireuse apparemment banale, syndrome dysentérique avec crampes, diarrhée sanglante avec signes toxi-infectieux. La maladie peut passer à la chronicité soit sous forme de colite soit sous forme de pseudo-tumeurs (amoebome) soit sous forme d’abcès hépatiques. L’amibiase ne provoque pas d’éosinophilie.
Les schistosomes provoquent une diarrhée aiguë banale avec éosinophilie. En l’absence de traitement, la maladie peut évoluer vers une schistosomiase hépatique.
4. Mycoses
¨ Candida, Histoplasma
Les entérocolites mycotiques se rencontrent principalement dans deux circonstances : après utilisation d’antibiotiques et chez les malades immunodéprimés.
Elles se manifestent principalement par une diarrhée aqueuse.
II. LES ENTERO-COLITES MEDICAMENTEUSES
De nombreux médicaments provoquent des colites ou des entérocolites.
|
|
Pathogénie |
|
Antibiotiques Laxatifs Vasopressine, digitaline, ergotamine Contraceptifs oraux Cytostatiques Sels d’or Salazopyrine, 5ASA AINS Suppositoires (aspirine, ergot de seigle) |
Clostridium difficile, staphylo, mycoses Troubles de perméabilité Vasoconstriction Thrombose, hypercoagulabilité Neutropénie, lésions épithéliales Réaction immunologique Hypersensibilité ¯ prostaglandines ¯ prostaglandines, troubles vasculaires |
L’apparition de troubles intestinaux bénins est fréquente après administration d’antibiotiques. Elle disparaît en général, spontanément à l’arrêt du traitement. Plus rarement la pullulation de staphylocoques et/ou de mycoses (candida) provoque une diarrhée persistante. Plus rarement encore apparaît une colite pseudo-membraneuse liée au clostridium difficile.
La maladie des laxatifs se manifeste sous des aspects cliniques polymorphes. Son existence est souvent méconnue car le malade est parfois très habile à dissimuler un usage prolongé et massif de laxatifs irritants. Elle survient dans un terrain particulier : dans 9 cas sur 10 il s’agit de femmes présentant des perturbations psychiatriques évocatrices.
Elle se manifeste par une diarrhée hydro-électrolytique pouvant conduire à une alcalose hypochlorhémique grave et des douleurs abdominales. Le diagnostic est confirmé par la recherche de laxatifs. Cette recherche est aisée pour la phénolphtaleïne, mais nécessite des chromatographies pour la détection du Bisacodyl (Dulcolax®). La présence d’une mélanose recto-colique peut être observée après la prise de dérivés antraquinoniques.
L’usage excessif de certains suppositoires (Aspirine, paracétamol, ergot de seigle) peut provoquer des ulcérations et des sténoses rectales.
III. LA COLITE ISCHEMIQUE
Voir le chapitre « ischémie intestinale ».
IV. L’ENTEROCOLITE RADIQUE
Les lésions résultant des radiations ionisantes peuvent frapper l’ensemble du tube digestif mais sont plus fréquentes au niveau du côlon terminal (sigmoïde et rectum) car la radio ou radiumthérapie est principalement utilisée pour traiter les lésions digestives ou gynécologiques du petit bassin. Leur fréquence et leur intensité augmentent proportionnellement à la dose administrée. Pour une dose de 5.000 rad., la fréquence est d’environ 10%. Ce chiffre est en diminution constante depuis l’amélioration des techniques d’irradiation. Pendant l’administration du traitement, les mitoses qui assurent le renouvellement cellulaire au niveau de la muqueuse sont en partie bloquées. Il en résulte des lésions superficielles, en général, réversibles. Plus tardivement, se manifestent les conséquences de l’irradiation des couches profondes et notamment des vaisseaux. De l’œdème, de la sclérose, voire même des nécroses peuvent survenir.
1. Formes aiguës
Les symptômes précoces (durant le traitement) vont d’une simple modification du rythme de défécation à des diarrhées parfois sanglantes rappelant la colite ulcéreuse. L’abdomen à blanc montre des anses grêles dilatées. Au transit grêle on observe des anses dilatées avec relief muqueux irrégulier. La côlonoscopie (atteinte colique) montre une muqueuse érythémateuse, friable, ulcérée.
Le traitement est surtout préventif (dosmétrie précise). La cholestyramine et le lopéramide sont utiles pour les lésions grêles. Des lavements au formol, aux corticoïdes ou au 5ASA peuvent être utilisées pour les formes coliques.
2. Formes chroniques
Plus tardivement (6 mois à 1 an ou plus après l’irradiation) apparaissent des signes de sub-occlusion, de malabsorption et des fistules. Le transit et le lavement baryté montrent des lésions rappelant soit celles de la maladie de Crohn (ulcérations muqueuses, rigidité, sténoses longues), soit celles des cancers (sténoses courtes). A l’endoscopie, outre des sténoses, la muqueuse est pâle et on observe des télangiectasies.
Le traitement sera celui de la malabsorption dans les formes grêles (avec éventuellement régime sans gluten, sans lactose et nutrition parentérale s’il existe une dénutrition). Des dilatations endoscopiques seront réalisées en cas de sténose rectale. Les entérites radiques doivent souvent être réséquées chirurgicalement. On évite les iléostomies..
V. ENTEROCOLITES RARES
LA COLITE COLLAGENE
Cette maladie rare est caractérisée par la présence d’une large bande de collagène sous-épithéliale. Sa pathogénie reste imprécise, peut-être auto-immune. Les symptômes comportent une diarrhée aqueuse chronique associée à des douleurs crampoïdes abdominales. La biologie est peu utile. Le diagnostic repose sur la biopsie du côlon car l’endoscopie n’est généralement pas contributive. Il n’y a pas de traitement spécifique.
LA COLITE LYMPHOCYTAIRE
Elle présente un tableau clinique similaire à celui de la colite collagène et explique probablement un certain nombre d’observations de « colopathies fonctionnelles ». Elle ne provoque pas d’anomalies macroscopiques de la muqueuse. L’histologie montre un tableau peu spécifique d’inflammation chronique du chorion. L’importante augmentation du nombre de lymphocytes intraépithéliaux est caractéristique de l’affection. La colite lymphocytaire a un cours chronique mais peut guérir spontanément.
LA COLITE DE DIVERSION
Il s’agit d’une inflammation non spécifique dont l’aspect évoque une colite ulcéreuse et survenant sur des segments coliques mis au repos (par une colostomie par exemple). L’étiopathogénie serait une pullulation microbienne ou un déficit en acides gras à courte chaîne qui sont un support énergétique pour l’épithélium. Le traitement est la remise en continuité, les lavements au 5ASA ou des lavements d’acides gras.
LA MELANOSE COLIQUE
L’usage prolongé de laxatifs de type anthracénique (cascara, séné, etc.) peut provoquer le dépôt dans la muqueuse colique d’un pigment noir dont la nature exacte reste imprécise. La localisation préférentielle est le caecum et le rectum, mais d’autres segments du tube digestif peuvent être atteints. A l’endoscopie, la muqueuse a une teinte bleu noir. Cette lésion ne provoque aucun symptôme et ne nécessite aucun traitement.
L’ULCERE SOLITAIRE DU RECTUM ET LA COLITE CYSTIQUE PROFONDE
L’ulcère solitaire du rectum se développe généralement chez des sujets jeunes surtout du sexe féminin présentant le plus souvent un prolapsus rectal.
Les lésions sont généralement localisées à la face antérieure du rectum. Elles se manifestent suivant le degré d’évolution par un aspect granulaire de la muqueuse, des érosions ou des ulcérations solitaires ou multiples.
Lorsque les biopsies sont assez profondes, l’image histologique est caractéristique. Elles comportent : une oblitération fibreuse de la muqueuse, la présence de nombreux faisceaux musculaires lisses dans le chorion muqueux, un épaississement et une fibrose de la muscularis mucosae dont les contours sont spéculaires, une inclusion de glandes dans la muscularis mucosae et la sous muqueuse (colite cystique profonde).
Très souvent asymptomatique, l’ulcère solitaire se manifeste parfois sous forme de dyschésie ano-rectale, associée à des douleurs anales parfois intenses et à des saignements modérés. Le diagnostic se fait par l’endoscopie avec biopsies, la défécographie et la manométrie anale.
Le traitement consiste à éduquer le patient en vue d’éviter les efforts de défécation. Des mucilages peuvent être utiles. Un traitement chirurgical (rectopexie) ne doit être envisagé qu’en cas d’échec du traitement médical et de prolapsus important.
LE SYNDROME DE BEHCET
Il associe à des degrés divers, des ulcérations oro-génitales, de l’iritis, de l’arthrite, des manifestations thromboemboliques et une colite pouvant mimer une maladie de Crohn ou une colite ulcéreuse.
CHAPITRE VI :
LES TUMEURS DE L’INTESTIN GRELE
Les tumeurs de l’intestin grêle sont rares (moins de 2% des tumeurs digestives).
I. ANATOMOPATHOLOGIE
A. TUMEURS EPITHELIALES
1. Tumeurs bénignes
Elles sont rares dans l’intestin grêle, à l’exception de la région de l’ampoule de Vater. On rencontre, toutefois, des polypes néoplasiques du grêle associés ou non au syndrome de polypose familiale.
2. Tumeurs malignes
Les adénocarcinomes sont excessivement rares comparativement à ceux du côlon et de l’estomac (exception : région de l’ampoule de Vater). Certaines affections prédisposent à leur développement, telles que la maladie cœliaque et la maladie de Crohn.
3. Tumeurs carcinoïdes
Le terme de carcinoïde a été utilisé dès 1908 par Obendorfer pour désigner des tumeurs prenant l’aspect macroscopique d’adénocarcinomes alors que leur pronostic était favorable. Ces tumeurs se développent aux dépens de cellules endocrines argyrophiles ou argentaffines que l’on trouve tout le long du tractus digestif. Elles sont plus fréquentes au niveau du grêle terminal et de l’appendice. On en rencontre près de 1% sur les pièces d’appendicectomie pour syndrome appendiculaire.
A l’examen macroscopique, les tumeurs forment des masses surélevées par rapport au plan muqueux ; elles ont fréquemment une forme en galette ; la partie centrale de la lésion s’ulcère progressivement réalisant un aspect en cupule. La tumeur carcinoïde est richement vascularisée et habituellement de couleur chamois. Une composante fibreuse fréquente entraîne une rétraction qui se marque par une encoche sur la face séreuse du viscère.
A l’examen microscopique on en décrit plusieurs types suivant qu’elles sont formées de nids, de larges bandes de cellules, de cordons tumoraux d’aspect rubané, de tubes glandulaires ou encore qu’elles s’étendent en nappes de cellules indifférenciées.
Les tumeurs carcinoïdes de l’intestin grêle sont douées de potentialité métastatique par voie lymphatique et par voie sanguine, essentiellement vers le foie, compte tenu de l’irrigation porte de l’intestin. Cependant, le pronostic reste relativement bon puisque la survie est longue même en présence de métastases disséminées. Les carcinoïdes de la pointe de l’appendice, les plus fréquents, ne métastasent pratiquement jamais, même s’ils envahissent toute la paroi du viscère, lorsque leur diamètre ne dépasse pas 6 mm.
Une large partie des tumeurs carcinoïdes de l’intestin grêle secrète de la 5-Hydroxytryptamine que l’on peut déceler dans les urines sous forme d’acide 5-Hydroxyindole acétique. Lorsqu’il existe des métastases hépatiques massives, on peut voir se développer un syndrome clinique particulier qualifié de syndrome carcinoïde, qui est provoqué par la sécrétion de substances vasoactives : 5-Hydroxytryptamine, substance P, bradykinine...
B. TUMEURS MESENCHYMATEUSES
1. Tumeurs stromales (léiomyomes, léiomyosarcomes)
Elles sont analogues à celles rencontrées dans l’estomac, mais sont beaucoup moins fréquentes ; les critères de malignité et le pronostic sont analogues à ceux des tumeurs gastriques.
2. Lymphomes primitifs du tube digestif de type occidental
Les lymphomes digestifs peuvent être primitifs ou secondaires. On considère comme primitif les lymphomes dont les localisations digestives apparaissent prédominantes ou dont les signes cliniques initiaux sont une atteinte digestive en l’absence d’atteinte antérieure des ganglions périphériques.
On distingue des lymphomes à faible malignité de type MALT (mucosa associated lymphoïd tissue) dérivés des cellules centrocyte like parafolliculaires et des lymphomes à haut degré de malignité dérivés des cellules folliculaires, comme les lymphomes des ganglions périphériques.
Les lymphomes du grêle sont un peu moins fréquents que les lymphomes gastriques tout au moins dans les pays européens. Dans les contrées en voie de développement, le lymphome intestinal tend à être nettement plus fréquent. Il s’agit alors de tumeurs frappant l’individu jeune et de haut degré de malignité. Les lymphomes intestinaux sont souvent multiples.
Le lymphome localisé donne naissance à une masse tumorale qui se développe vers la lumière du grêle et tend à s’ulcérer. Cette masse peut être volumineuse et devenir palpable. Le lymphome diffus infiltre la sous muqueuse en élargissant et en aplatissant les villosités.
La localisation préférentielle est l’iléon sauf pour les lymphomes compliquant une maladie cœliaque qui se localisent dans le jéjunum.
4. Maladies immunoprolifératives de l’intestin grêle (IPSID), Maladie des chaînes alpha, Lymphomes méditerranéens...
Il s’agit d’affections particulières caractérisées par une prolifération de cellules lymphoïdes B et se distinguant principalement par la présence d’immunoglobulines spécifiques.
Ils se rencontrent surtout chez les sujets jeunes (15 à 30 ans), le plus souvent originaires du bassin méditerranéen et de niveau socio-économique bas.
II. LES ADENOCARCINOMES ET LES TUMEURS CARCINOÏDES
A. MANIFESTATIONS CLINIQUES
1. Symptômes communs aux tumeurs du grêle
Très schématiquement, les manifestations cliniques générales des tumeurs du grêle peuvent être classées de la manière suivante :
¨ Une symptomatologie banale comportant des épigastralgies, des troubles du transit et une anémie.
¨ Un syndrome de subocclusion (syndrome de Koenig) comportant des douleurs post-prandiales souvent vives accompagnées de nausées et de vomissements et cédant brutalement avec des bruits hydro-aériques et une débâcle de gaz et de matières.
¨ Une symptomatologie aiguë (occlusion intestinale, hémorragie digestive, péritonite par perforation) apparaissant chez un malade jusque là exempt de signes digestifs.
2. Le syndrome carcinoïde
Des manifestations systémiques apparaissent lorsque diverses substances produites par les métastases hépatiques d’une tumeur carcinoïde sont libérées dans la circulation. Il s’agit d’une part de symptômes permanents, d’autre part d’accidents paroxystiques.
¨ Les manifestations permanentes comportent une diarrhée motrice, des manifestations cutanées (rougeur cyanique de la peau, télangiectasies) et des manifestations cardiaques (sténose pulmonaire, insuffisance ou rétrécissement tricuspidien).
¨ Les accidents paroxystiques, désignés sous le terme de flush, comportent des manifestations cutanées (phase de congestion débutant à la face accompagnée d’une sensation de chaleur et de larmoiement suivie d’une phase de pâleur et parfois de cyanose) et des manifestations cardio-vasculaires (palpitations, hypotension pouvant aboutir à un collapsus). Ces accidents sont déclenchés par les émotions, l’alimentation ou la prise d’alcool et la palpation des métastases.
B. DIAGNOSTIC
Le diagnostic repose essentiellement sur l’entéroscopie et le transit baryté du grêle.
La présence d’un syndrome carcinoïde sera confirmée par la détermination, dans les urines de 24 heures, du débit en acide 5-hydroxy-indolacétique.
C. TRAITEMENT
Le traitement des tumeurs épithéliales de l’intestin grêle est la résection chirurgicale.
Concernant l’adénocarcinome iléal, le traitement consiste à une résection grêle emportant le mésentère correspondant et 5 cm de sécurité au niveau des marges. La survie à 5 ans est d'environ 20 % en cas d'adénocarcinome.
Les tumeurs carcinoïdes ont en général une évolution plus lente.
En présence d’un syndrome carcinoïde, divers agents ont été préconisés en vue de limiter les symptômes invalidants : dérivés de la phénothiazine et antagonistes de la sérotonine. Des dérivés de la somatostatine à action prolongée sont actuellement préconisés pour freiner la diarrhée et les flushs (3 injections sous-cutanées/j). Les traitements chimiothérapiques (5 FU et streptozotocine) sont généralement décevants. On préconise actuellement la chimio-embolisation des métastases hépatiques.
Elles touchent souvent les régions, iléale, iléo-caecale, en particulier l’appendice. Sur base d’une symptomatologie appendiculaire, il est classique de découvrir un carcinoïde au cours de l’appendicectomie en urgence ou (pire !) sur la pièce opératoire. L’examen anatomo-pathologique est indispensable pour décider du traitement. Si la tumeur est localisée et de taille inférieure à 6mm, on estime que l’appendicectomie ou la résection en quartier d'orange est suffisante si un suivi est instauré.
Par contre, si le diamètre dépasse 6 mm, une résection iléo-caecale avec lymphadénectomie du pédicule vasculaire iléo-caecal est indispensable. Dans ce cas, le rétablissement de la continuité digestive est réalisé par anastomose iléo-colique latéro-latérale.
Si la découverte d’une tumeur carcinoïde généralisée au foie conduit souvent à un traitement palliatif (chimio-embolisation), la résection localisée de métastases métachrones est préconisée.
III. LES LYMPHOMES
A. LYMPHOMES COMMUNS (DE TYPE OCCIDENTAL)
Plusieurs causes favorisent le développement de lymphomes : la maladie cœliaque, l’hyperplasie nodulaire lymphoïde, l’hypogammaglobulinémie et l’immunodépression.
1. Manifestations cliniques et diagnostic
Les principales manifestations cliniques sont : des douleurs abdominales, des troubles du transit, une altération de l’état général ou le développement d’une masse abdominale. Chez 25% des malades, la première manifestation est une hémorragie, une perforation ou une occlusion.
Le diagnostic se fait par transit grêle (nodules, ulcérations, sténoses, masses), entéroscopie et tomodensitométrie (adénopathies, infiltration pariétale) ou par cœlioscopie.
En effet, la variabilité des présentations cliniques rend parfois le diagnostic difficile. La nécessité d’obtenir un staging et une histologie entraîne actuellement l’interniste ou le gastro-entérologue à imposer au patient une coelioscopie diagnostique. La fiabilité de cet examen sous narcose avoisine les 100 %.. Le chirurgien évite un quelconque geste inutile de résection, le traitement le plus efficace étant la chimiothérapie.
2. Traitement
La chimiothérapie occupe une place majeure dans le traitement des lymphomes. Le type de chimiothérapie utilisée dépend du degré de malignité de la tumeur.
La place de la chirurgie est moins importante. Elle permet dans des cas sélectionnés :
· De réduire la masse tumorale et de guérir les lymphomes de bas grade de malignité
· De supprimer les risques liés à la nécrose tumorale induite par la chimiothérapie.
Plus rarement, on aura recours à la chirurgie pour :
· Affirmer le diagnostic et de définir le type histologique
· Effectuer un bilan d’extension loco-régionale et ganglionnaire.
B. AUTRES LYMPHOMES (IPSID, …)
Leur survenue est favorisée par les agressions intestinales parasitaires ou infectieuses.
Les manifestations cliniques comportent essentiellement de la diarrhée, un amaigrissement et des douleurs abdominales.
Le diagnostic est posé par le transit grêle (plis épaissis pseudopolypoïdes), la tomodensitométrie (adénopathies rétro-péritonéales) et l’immunologie (mise en évidence de la protéine des chaînes a dans le sang, les urines, le liquide jéjunal ou l’infiltrat intestinal).
Le traitement consiste en une antibiothérapie au stade débutant et en une chimiothérapie à un stade avancé.
CHAPITRE VII :
LES TUMEURS BENIGNES DU COLON
I. ANATOMOPATHOLOGIE
Les tumeurs bénignes du côlon sont souvent, improprement, appelées « polypes du côlon ». A 65 ans, un tiers de la population est porteur d’au moins un polype. Ce terme ambigu désigne à la fois des tumeurs vraies et des formations pseudo-tumorales. Elles ont en commun d’être en saillie dans la lumière intestinale. Elles peuvent être sessiles ou pédiculées.
|
CLASSIFICATION DES POLYPES
RECTO-COLIQUES |
|
|
POLYPES NON NEOPLASIQUES · Polype hyperplasique · Polype de Peutz-Jeghers · Polype juvénile · Polype inflammatoire (ou pseudo-polype) Polype lymphoïde |
|
|
POLYPES NEOPLASIQUES · Adénome tubulo-villeux · Adénome tubuleux · Adénome villeux |
Risque de cancérisation intermédiaire faible élevé |
|
POLYPOSES · Polypose adénomateuse familiale · Syndrome de Peutz-Jeghers · Polyposes diverses |
très élevé peu élevé |
|
Des lésions sous-muqueuses de type mésenchymateux
(lipome, léiomyome, formations lymphoïdes, ...) peuvent également prendre la
forme de polypes qui sont alors recouverts par une muqueuse normale. |
|
A. POLYPES NON NEOPLASIQUES
1. Polypes hyperplasiques
Ce sont de petites lésions sessiles, de moins de 5 mm de diamètre, faisant saillie à la surface de la muqueuse et de même couleur que cette dernière. Ils sont constitués de glandes de grande taille, à disposition régulière, dont la lumière est crénelée. L’épithélium de revêtement est bien différencié et ne montre jamais de signe de dysplasie.
La croissance d’une telle lésion est très lente ; elle est la conséquence d’un déséquilibre entre production et desquamation cellulaire mais il n’existe pas de perturbation dans les mécanismes fondamentaux de la morphogenèse glandulaire.
On a décrit récemment une forme particulière de polype hyperplasique : le polype hyperplasique « inversé » dans lequel des structures glandulaires se projettent vers la profondeur de la muqueuse et débordent largement sur la sous-muqueuse. Il existe un danger d’interpréter cette lésion comme un carcinome à cause de l’image trompeuse d’invasion de la muscularis mucosae et de la sous-muqueuse.
2. Polype de Peutz-Jeghers
Le polype de Peutz-Jeghers peut se voir de façon isolée ou entrer dans le cadre plus vaste du syndrome de Peutz-Jeghers (polypose diffuse dans tout le tube digestif mais prédominant dans le grêle et lentiginose cutanéo-muqueuse). Il est peu fréquent dans le côlon. Sa surface est lisse ou discrètement lobulée ; histologiquement, il est constitué de structures glandulaires bien différenciées entre lesquelles courent des faisceaux musculaires lisses provenant d’une muscularis mucosae hyperplasiée et arborescente.
3. Polype juvénile
Le polype juvénile se rencontre chez l’enfant mais s’observe de manière sporadique chez l’adulte. Il se présente comme une masse arrondie ou ovalaire, souvent pédiculée, de couleur rouge vif, saignant au contact. Son stroma est riche en fibroblastes et éléments inflammatoires et renferme des structures glandulaires dilatées, voire kystiques. On décrit une polypose juvénile de caractère héréditaire.
4. Polypes inflammatoires
Ils se rencontrent dans les colites chroniques et notamment dans la recto-colite ulcéro-hémorragique.
5. Polypes lymphoïdes et polypose lymphoïde bénigne
Ces lésions forment des surélévations bien délimitées, arrondies, à surface lisse, prédominant dans le rectum. Les polypes isolés se voient surtout chez l’adulte tandis que la polypose lymphoïde se rencontre chez l’enfant. Il s’agit dans les deux cas d’une hyperplasie des follicules lymphoïdes normalement présents dans le côlon en réponse à une stimulation locale (infection bactérienne, virale, ...).
B. POLYPES NEOPLASIQUES
1. Adénome tubuleux (polype adénomateux)
Il est souvent de petite taille, rosé, à surface lisse, parcouru par de profondes incisures. Lorsqu’il est de taille suffisante (supérieur à 1 cm), il est en général pédiculé. A l’examen microscopique, il est constitué de glandes néoformées, de grande taille, ramifiées, bordées par un épithélium peu ou moyennement différencié, pseudostratifié.
Dans sa profondeur, on peut retrouver des glandes normales, bien différenciées et sécrétoires, parfois distendues suite à l’obstruction de leur collet.
Les études de cinétique cellulaire montrent que la prolifération cellulaire est localisée près de la surface à l’inverse de ce qui s’observe dans une crypte colique normale. On assiste, dès lors, à une véritable inversion fonctionnelle dans laquelle les cellules néoformées migrent vers la profondeur où elles desquament difficilement. Il en résulte un tassement des cellules et des noyaux qui contribue à donner un aspect basophile aux glandes adénomateuses.
2. Adénome villeux (polype villeux)
Il est en général sessile, de plus grande taille et de consistance plus molle que le polype adénomateux. Sa surface est irrégulière, chevelue. Il est constitué de projections papillaires fortement ramifiées dont l’axe fibrovasculaire est grêle et l’épithélium de revêtement pseudostratifié, peu ou moyennement différencié. La désorganisation architecturale est plus grande que dans les polypes adénomateux. Les études de cinétique cellulaire montrent une répartition irrégulière des cellules en synthèse, tout le long des axes papillaires. Le polype villeux peut atteindre des dimensions très importantes ; on parle alors de tumeur villeuse.
3. Adénome tubulo-villeux (polype adénovilleux)
Il constitue une forme histologique intermédiaire caractérisée par la présence de courtes projections papillaires en surface et de glandes irrégulières en profondeur.
4. Polypose adénomateuse familiale
Il s’agit d’une maladie héréditaire rare se transmettant sur le mode autosomal dominant. Elle se manifeste par l’apparition de nombreux adénomes (jusqu’à plus de cent), pour la plupart tubuleux, au niveau du côlon. Les lésions se développent après la puberté, jusqu’à 40 ans. La transformation maligne (un ou plusieurs adénocarcinomes) est la règle en l’absence de traitement chirurgical. L’anomalie génétique (chromosome 5) est présente dans toutes les cellules de l’organisme ce qui explique que certains patients présentent également des adénomes du grêle et de l’estomac et des tumeurs mésenchymateuses (ostéomes, fibromes, tumeurs desmoïdes).
La polypose adénomateuse familiale à haute fréquence de dégénérescence maligne doit être distinguée d’autres formes de polyposes tels le syndrome de Peutz-Jeghers (association d’hamartomes coliques et de pigmentation buccale et cutanée), la polypose juvénile (hamartomes multiples) ou le syndrome de Cronkhite-Canada (polypose juvénile, alopécie, pigmentation cutanée et entéropathie exsudative) où la fréquence de dégénérescence est faible voire même nulle.
II. LA FILIATION POLYPE – CANCER
La filiation polype-cancer est bien établie. Sur 1.000 polypes néoplasiques, 35 se cancérisent en 10 ans en moyenne. Deux critères de risque se dégagent des données de la littérature : la taille et le contingent de structures villeuses. Les lésions de grande taille, à forte composante villeuse et à base d’implantation large présentent un caractère nettement péjoratif. Les adénomes tubuleux purs dégénèrent beaucoup plus rarement.
III. MANIFESTATIONS CLINIQUES ET DIAGNOSTIC
A. ADENOME TUBULEUX
L’adénome tubuleux est en général asymptomatique, et il est le plus souvent découvert au cours d’un examen endoscopique ou radiologique réalisé dans le cadre de la mise au point d’une colopathie. Occasionnellement, des pertes intermittentes de sang rouge peuvent être observées au moment des selles. L’exploration, soit endoscopique, soit radiologique, de l’entièreté du côlon est indispensable car le développement simultané de plusieurs adénomes tubuleux n’est pas exceptionnel ; la présence d’un cancer synchrone doit également être recherchée.
B. ADENOME VILLEUX
Les symptômes de l’adénome villeux de petite taille sont identiques à ceux des adénomes tubuleux. Seul l’examen anatomopathologique permet de les différencier.
Une forme clinique plus caractéristique est parfois observée. Elle est découverte au niveau du rectum chez les malades de plus de 60 ans. La tumeur (tumeur villeuse) est volumineuse (5 à 15 cm) et, par son volume, provoque, outre des écoulements muco-sanglants, du ténesme et des symptômes de subocclusion. Occasionnellement, la tumeur secrète des quantités importantes de mucus (jusqu’à plusieurs litres par jour), et des troubles hydro-électrolytiques sévères (hyperchlorémie, hyponatrémie, hypokaliémie, urémie) se développent. Le toucher rectal révèle la présence, dans le rectum, d’une volumineuse masse molle. L’endoscopie et la radiologie permettent d’établir le diagnostic. Près de la moitié de ces tumeurs villeuses ont dégénéré au moment du diagnostic. Cette dégénérescence peut être difficile à établir à cause du volume important de la tumeur dont une partie seulement est cancéreuse.
C. LA POLYPOSE FAMILIALE
Exceptionnellement
présente avant 15 ans, la PAF se manifeste une fois sur deux avant 35 ans. Les
signes cliniques peuvent ne consister qu'en gênes abdominales intermittentes.
Mais, habituellement, des symptômes plus marqués apparaissent : hémorragies digestives, diarrhée, accidents
subocclusifs, anémie ferriprive.
Depuis l’instauration du Registre Belge de la Polypose (Familial Adenomatosis Polyposis Association), on détecte les familles porteuses et on réalise un screening de l’ADN systématiquement. Le fond d’œil (hypertrophie de l’épithélium rétinien) est facile et fiable. L'examen radiologique et la colonoscopie permettent de découvrir la présence de polypes multiples et, éventuellement, d'un ou de plusieurs carcinomes associés.
Le caractère héréditaire et la gravité de l'affection imposent une enquête génétique familiale avec réalisation d'un fond-d'oeil (hypertrophie de l'épithélium rétinien), des recherches génétiques par biologie moléculaire (recherche du gène mutant sur le chromosome 5) et des colonoscopies itératives à partir de l'âge de 12 ans.
IV. TRAITEMENT
A. ADENOMES ISOLES
Les adénomes, lésions potentiellement malignes, doivent être réséqués.
A de rares exceptions près, la résection sera réalisée endoscopiquement au moyen d’une anse diathermique (polypectomie endoscopique). La polypectomie doit être suivie d’une surveillance étroite pendant 8 jours, afin de déceler et de traiter, en général chirurgicalement, les complications (hémorragie et perforation) qui sont toutefois très rares.
Le polype doit obligatoirement être confié à un anatomopathologiste, car la suite du traitement dépend du résultat de cette analyse. Il est important que, pour les polypes de grande taille, l’endoscopiste place un repère sur la marge de résection de manière à permettre une orientation correcte du polype. Le pathologiste pourra alors réaliser dans des conditions optimales l’étude des paramètres suivants : aspect villeux ou tubulaire, présence et pénétration en profondeur d’une dégénérescence cancéreuse, intégrité des marges de résection. Si le polype est entièrement bénin ou s’il existe une dégénérescence cancéreuse ne franchissant pas la muscularis mucosae (sur des coupes sériées), le traitement est terminé. Si le polype présence un carcinome invasif il y a un risque (de l’ordre de 10%) de présence résiduelle de tissu cancéreux dans la paroi ou les ganglions. Ce risque est lié à plusieurs paramètres histologiques : tumeur peu différentiée, présence de signes d’invasion veineuse ou lymphatique, marge de résection envahie, degré d’invasion de la sous muqueuse (particulièrement en cas de polype sessile). En présence de l’un de ces paramètres, une résection chirurgicale complémentaire sera proposée en tenant compte du risque opératoire.
Les volumineux polypes villeux rectaux doivent, a priori, être considérés comme des cancers. Le traitement de ces lésions est donc la résection chirurgicale du rectum. Toutefois, on hésitera parfois à pratiquer une telle intervention chez les vieillards. Des résections locales (chirurgicales ou endoscopiques) seront, dans ces cas, jugées suffisantes.
Le défi fonctionnel (maintien de la continence anale et d’un réservoir) conditionne le choix de l’abord. Si la lésion ne dépasse pas 33 % de la circonférence rectale, une résection trans-anale peut être envisagée. Dans le cas contraire, une anastomose colo-anale est proposée.
Une surveillance endoscopique à long terme des malades ayant subi une polypectomie doit être réalisée. En effet, le développement de nouveaux polypes n’est pas exceptionnel (jusque 60% des malades dans certaines séries) et l’incidence des cancers du côlon (développés à partir de polypes adénomateux ou indépendamment de ceux-ci) est plus fréquente que dans la population normale. L’intervalle entre deux examens sera de 3 à 5 ans. Cet intervalle sera ramené à 1 an chez les malades porteurs de polypes multiples, en cas de résection incomplète ou d’histologie suspecte de carcinome invasif.
B. POLYPOSE ADENOMATEUSE FAMILIALE
La fréquence élevée des transformations malignes implique la nécessité d'une résection précoce et étendue. même si le malade est asymtomatique. Plusieurs techniques peuvent être proposées :
· La majorité des malades sont actuellement traités par procto-colectomie restauratrice. L’intervention consiste à pratiquer une colectomie de la valvule de BAUHIN aux releveurs. Le rectum inférieur est alors divisé en son feuillet muqueux et le sphincter interne préservé. Une mucosectomie totale jusqu’à 1 cm de la ligne pectinée complète la résection préventive. Après libération du cadre duodéno-pancréatique et allongement du pédicule iléo-caecal préservé soigneusement, un réservoir iléal en J est réalisé mécaniquement. Il est abaissé au centre de l’enveloppe des releveurs et de l’appareil sphinctérien pour terminer par une suture iléo-anale latéro-terminale manuelle. Une iléostomie latérale temporaire en amont du réservoir protège classiquement le montage pendant 6 semaines permettant de commencer la rééducation physiothérapique. Dans les meilleurs cas, cette iléostomie est évitée. Pendant 18 mois, un suivi anuscopique, physiothérapique et diététique est indispensable. Le patient doit prendre 2 à 8 comprimés d’Imodium* . La durée et le dosage sont individuels et imprévisibles. Une cotation sur une échelle de confort de vie complète ce suivi à long-terme. On avoisine 27/30 de qualité de vie après 18 mois (continence, profession, famille, sexe, sport,….)
· Une procto-colectomie totale (ablation de tout le côlon, du rectum et de l'anus), complétée par une iléostomie iliaque droite définitive. Si un adénocarcinome est déjà présent, particulièrement au niveau du rectum, le chirurgien doit faire passer la priorité à la résection du mésorectum (voir cancer rectal).
La reconstruction est alors prohibée ; diverses techniques ont été développées pour rendre ces iléostomies plus continentes (création au moyen du grêle terminal d'une poche munie d'une valve). Les résultats fonctionnels obtenus sont aléatoires. Chez le patient préalablement incontinent ou en cas de pathologies empêchant l’abaissement iléo-anal (séquelles d’adénopathies, adhérences mésentériques, fibrose rétropéritonéales…), la coloproctectomie totale est obligatoire. Quelques soient les techniques parfois fantaisistes proposées par certains chirurgiens, la résection complète de rectum est la règle d’or scientifique pour tous les centres de pointe.
Anastomose iléo-anale
|
|

CHAPITRE VIII :
LES TUMEURS MALIGNES DU COLON
Le cancer colorectal est la troisième cause de cancer chez l’homme (après le poumon et la prostate) et la deuxième cause chez la femme (après le sein).
L’incidence augmente avec l’âge, en particulier après 50 ans.
I. ANATOMOPATHOLOGIE
La plupart des tumeurs malignes du côlon sont des adénocarcinomes.
La distribution varie avec le temps et l’âge : la localisation préférentielle est le recto-sigmoïde mais 40% des cancers sont situés en amont de l’angle splénique.
Les cancers du côlon sont fréquemment multiples (synchrones ou métachrones). Ceci signifie que, en présence d’un cancer, il importe de réaliser un examen soigneux du restant de la muqueuse colique et de mettre le patient opéré sous surveillance endoscopique.
On décrit enfin des syndromes familiaux à haute incidence de cancer colique (HNPCC- Hereditary Non Polyposis Colorectal Cancer ou syndrome de Lynch). Les tumeurs apparaissent, en général, chez des patients jeunes.
A. ADENOCARCINOME
1. Etude macroscopique
Au moment de leur découverte, la plupart des adénocarcinomes sont de relativement petite taille et leur degré d’infiltration reste limité.
La forme macroscopique la plus fréquente est le type ulcéro-nodulaire qui forme un cratère ulcéré à bords ourlés, bourgeonnants et saillants. Le cancer en virole est de ce type ; il est caractérisé par un développement annulaire entraînant une sténose tubulaire de la paroi. Les formes polypoïdes et végétantes forment des masses protubérantes, parfois de grande taille, de configuration villeuse. Contrairement à l’estomac, les cancers infiltrants (linite plastique) sont rares ; lorsqu’on les rencontre, il faut suspecter une métastase intracolique d’une tumeur originaire d’un autre organe (estomac) (fig. 9).
Fig. 9 Cancer ulcéro-nodulaire et
sa traduction radiologique
2. Etude microscopique
Près de 80% des cancers coliques sont bien ou moyennement différenciés. La présentation histologique peut être modifiée par des zones de nécrose, par une réaction desmoplasique (réaction stromale) ou par la présence de structures papillaires. 15 à 20% des cancers sécrètent du mucus. Cette sécrétion peut se marquer à l’examen macroscopique par un aspect opalescent qualifié de colloïde.
La mucine peut s’accumuler dans des glandes dilatées ou former des lacs où baignent des rubans de cellules néoplasiques.
20% des adénocarcinomes sont peu différenciés et présentent des signes de malignité cellulaire évidents (polymorphisme nucléaire, mitoses anormales). Les cancers indifférenciés ne montrent aucune tendance à la formation de tubules.
3. Dissémination extra-pariétale
Les cancers coliques peuvent disséminer localement en se propageant le long des plans conjonctifs. Les tumeurs indifférenciées ou de caractère muco-cellulaire montrent une tendance à s’étendre dans la sous muqueuse et à déborder la paroi recto-colique ; le péritoine est cependant résistant et l’envahissement de voisinage relativement peu fréquent. Des fistules et des adhérences avec les organes contigus peuvent s’observer. Elles résultent soit de la propagation tumorale soit d’une surinfection de la tumeur qui entraîne la formation d’abcès profonds.
Les cancers recto-coliques métastasent par voie lymphatique vers les chaînes mésentériques et para-aortiques. Les tumeurs rectales bas situées peuvent se propager dans les ganglions inguinaux.
Les implants intra-péritonéaux peuvent provoquer une péritonite carcinomateuse ou former des nodules tapissant la séreuse. La propagation à l’ovaire donne (rarement par rapport à l’estomac) des tumeurs de Krukenberg.
Les métastases veineuses sont souvent tardives. Le foie est l’organe le plus fréquemment atteint. Suivent dans l’ordre de fréquence, les poumons, les surrénales les os et le cerveau.
4. Récidives après exérèse
Les récidives se voient surtout après intervention pour cancers rectaux dont le curage chirurgical s’avère parfois incomplet. Trois types de récidives peuvent être décrites :
· Au niveau de la suture chirurgicale (implantation de cellules tumorales au moment de l’intervention) en cas de non-respect des marges de sécurité ou d'extemporanée.
· Dans la profondeur de la paroi et dans les tissus péri-coliques au départ de cellules tumorales ayant migré à distance du foyer tumoral par les lymphatiques ou d'emboles vasculaires.
· Les plus fréquentes sont extra-pariétales et se situent au niveau de ganglions métastatiques irrésecables ou mésestimés lors de l’intervention.
B. TUMEURS CARCINOÏDES
Elles sont rares dans le côlon. On les rencontre surtout au niveau du caecum et du rectum. La plupart forment de larges masses dotées de potentialité métastatiques. Au niveau du rectum, on décrit toutefois des tumeurs carcinoïdes de petite taille, d’un diamètre de moins d’un cm dont l’exérèse locale s’avère suffisante.
C. TUMEURS MESENCHYMATEUSES
1. Lymphomes
En dehors des manifestations métastatiques secondaires à un lymphome périphérique, on rencontre dans le côlon des lymphomes malins nettement plus rares que dans l’estomac ou l’intestin grêle. La plupart de ces tumeurs sont de haut grade. Une forme particulière de lymphome digestif se rencontre dans l’intestin grêle et le côlon : la polypose lymphomateuse maligne.
Tumeurs stromales
Les tumeurs stromales ont un comportement similaire aux tumeurs gastriques de même type.
II. MANIFESTATIONS CLINIQUES
La majorité des adénocarcinomes du côlon débute entre 50 et 80 ans sans prédominance de sexe.
Les seuls symptômes précoces sont des troubles fonctionnels (diarrhée, constipation, alternance de diarrhée et de constipation) et des hémorragies digestives basses intermittentes peu abondantes entraînant parfois de l’anémie. Au toucher rectal, le cancer du rectum se présente comme une masse irrégulière et indurée. Toute modification du rythme des défécations, toute perte de sang par l’anus et toute anémie d’origine inexpliquée apparaissant chez un malade de plus de 40 ans, imposent formellement une exploration complète du côlon.
A un stade plus avancé, le cancer du côlon va provoquer l’apparition de douleurs abdominales par subobstruction. Les lésions rectales ayant atteint un volume de plus de 5 cm provoquent du ténesme (besoin de défécation non suivi d’effets), l’évacuation de selles de petit calibre, et, plus rarement, des douleurs crampoïdes de l’hypogastre (épreintes). Plus tardivement encore, apparaissent des signes de généralisation (hépatomégalie, ascite).
Les complications les plus fréquentes du carcinome colique sont l’occlusion intestinale et la perte de sang au moment de l'exonération. Environ 20% des cancers du côlon gauche et 10% des cancers du côlon droit se présentent d’emblée en subobstruction ou en obstruction complète. La symptomatologie de l’obstruction sera décrite dans le tome 3, chapitre 1 de ce syllabus. La perforation de la tumeur en péritoine libre et l’hémorragie basse massive sont plus rares.
III. PREVENTION ET FACTEURS DE RISQUE DU NEOPLASME (POLYPES ET CANCER) COLORECTAL
La responsabilité de facteurs de l’environnement est controversée : excès de graisses, manque de fibres, tabagisme, alcoolisme. L’aspirine et les AINS réduiraient l’incidence.
Les facteurs génétiques sont aussi importants : Polypose Adénomateuse Familiale, cancers familiaux (syndrome de Lynch),….
En fonction des facteurs de risque, on peut proposer une stratégie de dépistage qui permet de diminuer la mortalité par cancer colorectal (cf. tableau).
Le dépistage par recherche de sang occulte ne s’applique qu’à large échelle selon une politique nationale. Le taux de positivité du test est de 3%. Malgré le problème des faux positifs, le test permet de découvrir précocément des polypes et des tumeurs cancéreuses.
|
DEPISTAGE DE NEOPLASIE COLORECTALE
EN FONCTION DES FACTEURS DE RISQUE |
||
|
MOYEN |
ELEVE |
TRES
ELEVE |
|
Age >
50 ans 90 % des cancers colorectaux |
·
antécédents familiaux de néoplasme colorectal (risque
plus élevé si cancer versus adénome, si âge du patient < 60 ans, si
plusieurs membres du 1er degré atteints) ·
signes d’alarme
(déficience en fer, perte de poids) et âge
> 45-50 ans. ·
antécédents personnels de néoplasme colorectal ·
colite inflammatoire (RCUH,
Crohn) évoluant depuis plus de 8 ans. |
·
Polypose familiale
(PAF) ·
Syndrome de Lynch
(HNPCC) |
|
Sigmoïdoscopie
tous les 5 ans ou
colonoscopie totale tous les 10 ans |
Colonoscopie
totale |
Biologie
moléculaire Colonoscopie
totale Rôle préventif de la procto-colectomie restauratrice Suivi
gynécologique Transit
grêle, gastroscopie (PAF) |
IV. DIAGNOSTIC
A. DIAGNOSTIC DE LA TUMEUR
Le diagnostic sera établi par l’utilisation de l’endoscopie et du lavement baryté. Toutes les lésions accessibles à l’endoscopie seront biopsiées. Il faut garder à l’esprit la présence possible de lésions doubles ou multiples.
A l’endoscopie, on observe une tumeur bourgeonnante, ulcérée et saignant au contact.
A la radiographie, les images les plus fréquentes du cancer du côlon sont :
La présence d’une image lacunaire (« polype »). Rappelons que plus un polype est gros, plus il a de chance d’être un cancer. Les « polypes » sessiles ou multiples ont également de grandes chances d’être néoplasiques.
La présence d’une sténose courte, présentant un bourrelet à sa partie proximale et distale (culotte de golf ou trognon de pomme), une rigidité des parois et une destruction des plis muqueux.
B. BILAN PRETHERAPEUTIQUE
La prise en charge d’une néoplasie colique dépend étroitement de la politique de prévention, du dépistage et de l’identification précoce des cancers. Les politiques de santé, les ressources financières et la conscience individuelle de la population à risque s’ajoutent à la compétence médicale pour aider le généraliste à dépister le cancer avant une éventuelle complication grave (occlusion digestive, perforation…) qui change notablement traitement et pronostic.
Excluons de ce chapitre les présentations aiguës qui sont traitées dans l’abdomen aigu. En cas de chirurgie urgente, aucun bilan n’est possible. On réanime et on pratique une colostomie en urgence. Une stratégie est envisagée secondairement. Par contre, dans la majorité des cas en Belgique, le patient est évalué avant le traitement.
Comme pour d’autres néoplasies, les mots-clés sont OPERABILITE et RESECABILITE. Après histologie, on différencie le traitement PALLIATIF et de celui qui sera CURATIF.
L’opérabilité et le score ASA doivent être évalués collégialement, certainement avec le concours de l’anesthésiste et du chirurgien. Eux seuls disposent des informations objectives pour coupler le choix de la technique anesthésique et le choix d’une procédure chirurgicale adaptée à chaque patient. Quant à la stratégie à visée palliative, parfois induite par une inopérabilité absolue, elle ne devrait être choisie qu’après consultation médico-chirurgicale, incluant le chimiothérapeute et le radiothérapeute.
La résécabilité peut être curative ou palliative. Les potentialités peuvent être évaluées par :
· la palpation abdominale.
· la tomodensitométrie.
· le lavement baryté.
Et pour le cancer rectal, outre les
examens précités:
· le toucher rectal.
· l’écho-endoscopie
· un examen gynécologique (écho trans-vaginale)
· la cystoscopie.
L'envahissement hépatique est mis en évidence par :
· la palpation hépatique.
· l'échotomographie percutanée ou per-opératoire (la plus fiable mais opérateur-dépendante.
· les tests hépatiques.
· la tomodensitométrie.
L'envahissement ganglionnaire ne peut être évalué avec certitude qu’au moyen de biopsies extemporanées réalisées au cours d'une laparotomie. En cas de localisation rectale, l’échoendoscopie apporte une fiabilité très correcte quant à l’envahissement des ganglions lymphatiques. La résécabilité doit être intégrée sur base de la fiabilité des explorations en imagerie. Le CT scanner fournit des informations sur l'effet de masse dans la cavité pelvienne. Il peut, dans 85% des cas, inviter à recourir à une radiothérapie pré-opératoire. Cet examen reste peu fiable (faux négatifs) pour les envahissements ganglionnaires, mieux approchés par l'échoendoscopie (fiabilité: ± 90%).
La présence d'une tumeur < 10 cm accompagnée d'adénopathies suspectes pose le problème du choix entre une radiothérapie néoadjuvante ou la résection mésorectale totale (TME).
Le staging complet TNM est donc indispensable avant de proposer le traitement pluridisciplinaire.
La radiothérapie postopératoire est abandonnée au profit de la chimioradiothérapie néoadjuvante ou mieux de la résection du mésorectum.
V. TRAITEMENT
Comme pour toutes les tumeurs digestives, le traitement peut avoir une visée curative ou une visée palliative. Dans le premier cas, l'exérèse chirurgicale de la lésion et la lymphadénectomie sont essentielles. Si un traitement "curatif" est impossible, des traitements chirurgicaux ou non chirurgicaux visant essentiellement à prolonger et à rendre plus confortable la survie du malade sont proposés (= traitement palliatif).
Pour établir un plan thérapeutique, il faut tenir compte des éléments suivants :
A. Localisation et topographie anatomique .
B. Classification T.N.M.
C. Le bénéfice de la radiothérapie pré-opératoire (rectum)
D. Le bénéfice de la chimiothérapie post-opératoire selon âge et stade.
E. Le traitement des présentations aiguës.
A. LOCALISATION ET TOPOGRAPHIE ANATOMIQUE
L'étendue des exérèses "curatives" est guidée par la
nécessité, généralement admise, de la résection du premier relais
ganglionnaire. Les lymphatiques et
ganglions étant situés le long des vaisseaux, il faut réséquer ceux-ci et c'est
cette exérèse vasculaire qui va, le plus souvent, guider l'étendue de la
résection colique.
On distingue 6 territoires :
· L’artère iléo-caecale
· L’artère colique droite
· La colica media
· L’artère colique gauche
· L’artère sigmoïdienne issue de la mésentérique inférieure
· Le rectum
Types de colectomie selon la topographie de la tumeur
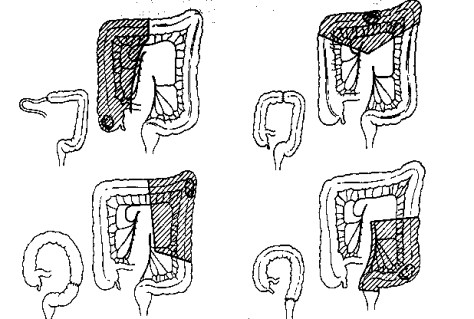
1. Cancer du caecum et du colon ascendant
L'exérèse ganglionnaire impose le sacrifice des artères iléo-colique et colique droite moyenne. Tout le côlon droit étant dévascularisé, il faut pratiquer une hémi-colectomie droite complétée par une anastomose iléo-transverse latéro-latérale puisque la discordance de calibre prohibe une anastomose iléo-colique bout-à-bout.
2. Cancer du côlon transverse
Le relais principal est situé le long de l'artère colique droite supérieure qui doit être sectionnée à sa base. La totalité du côlon transverse est dévascularisée et doit être réséquée. La continuité digestive est rétablie par anastomose colo-colique termino-terminale, ou latéro-latérale.
Des métastases ganglionnaires peuvent occasionnellement être trouvées au niveau de l'artère colique droite moyenne. Pour cette raison, certains chirurgiens étendent la résection à la totalité du côlon droit, en rétablissant la continuité par une anastomose entre l'iléon et le côlon gauche.
3. Cancers de l'angle splénique et du côlon descendant
Le relais ganglionnaire principal étant situé le long de l'artère colique gauche, il faut sacrifier cette artère, ce qui impose une résection segmentaire importante du côlon gauche. Le transit est rétabli par anastomose colo-colique.
Les ganglions situés en amont de l'artère colique gauche, c'est-à-dire, au niveau de l'origine de l'artère mésentérique inférieure peuvent être envahis et il paraît logique à d'aucun de sacrifier cette dernière artère au ras de l'aorte. La totalité du côlon gauche est, dans ce cas, dévascularisée et doit être sacrifiée. La continuité digestive est rétablie par anastomose entre le côlon transverse mobilisé et le haut rectum. Quoiqu'il n'ait pas été démontré clairement que cette exérèse élargie (hémi-colectomie gauche) donne des survies supérieures à celles d'une résection moins étendue, elle peut être proposée.
4. Cancer de la boucle sigmoïdienne
Le relais ganglionnaire principal se trouve le long du tronc commun des artères sigmoïdiennes qui doit être sacrifié. La totalité de la boucle sigmoïdienne est dévascularisée et doit être réséquée. La continuité digestive est rétablie par anastomose termino-terminale ou latéro-latérale. Les difficultés d’abaissement peuvent contraindre à décrocher l’angle splénique.
5. Cancer du rectum
Le traitement du cancer rectal est complexe et vient d’être réactualisé à la lumière des lymphadénectomies et des traitements adjuvants. Les 10 derniers cm du rectum, souvent concernés par le cancer colo-rectal, se trouvent sous le cul de sac de Douglas, conférant à celui-ci un statut extra-péritonéal. Autre caractéristique, le péritoine viscéral absent ne joue aucun rôle de barrière à effracter par la tumeur. Enfin, sa vascularisation provient des artères hémorroïdaires supérieures, moyennes et inférieures, donc de 6 pédicules vasculaires différents, chacun pourvu d’un drainage lymphatique. Pour couronner le tout, sa dissection menace les plexus neurovégétatifs sexuels, les glandes séminales chez l’homme et l’appareil sphinctérien anal.
Proximalement, le cancer du rectum impose, au minimum, le sacrifice de la mésentérique inférieure, immédiatement après le départ de l’artère colique gauche supérieure et donc le sacrifice du sigmoïde. La transposition colique vers le bas requiert donc la mobilisation du colon gauche.
Quels sont les quatre défis du chirurgien vis-à-vis du
cancer rectal ?
·
La curabilité
Le taux de récidive locale, faible (< 5 % dans la localisation transverse par exemple) dépend étroitement de la distance de la tumeur par rapport à la ligne pectinée. Plus le cancer est distal, plus le taux de récidive est menaçant .
Taux de récidive locale d’un cancer rectal en %
selon le niveau en cm :
Depuis 1993, les premières études faisant état d’un bénéfice significatif de la résection du mésorectum son apparues. Il ne fait actuellement plus aucun doute que sous les 10 cm (par rapport à la ligne pectinée, le mésorectum doit être réséqué. Ceci exige une dissection approfondie de l’espace pré-sacré et des ailerons du rectum. La graisse périrectale doit être ôtée jusqu'au plan des releveurs soit à hauteur du début du sphincter interne. Se pose alors le problème du choix du type d’anastomose : soit il reste une collerette permettant de réaliser une anastomose trans-suturaire mécanique, soit il faut réaliser une anastomose colo-anale manuelle par voie trans-anale .
·
La restauration de la fonction ano-rectale
Quatre techniques différentes permettent la résection carcinologique d’un cancer rectal :
1)
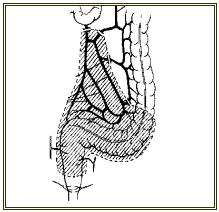 L’opération
de DIXON WANGENSTEEN aussi appelée résection antérieure du rectum
L’opération
de DIXON WANGENSTEEN aussi appelée résection antérieure du rectum
Elle consiste en une exérèse du sigmoïde et du haut rectum réalisée par voie abdominale et complétée par une anastomose colo-rectale. Elle respecte le bas-rectum et voit ses indications réduites depuis la nécessité de réséquer le mésorectum. Si les 10 derniers cm de rectum sont épargnés, elle ne laisse pas de séquelles fonctionnelles majeures.
2)
 L’opération
de MILES aussi dénommée amputation abdomino-périnéale
L’opération
de MILES aussi dénommée amputation abdomino-périnéale
L'amputation abdomino-périnéale du rectum (opération de MILES) consiste en une ablation totale du rectum, de l'anus et des releveurs, complétée par une colostomie gauche définitive (anus artificiel iliaque gauche). Le mésorectum est réséqué.
3) La proctorectomie restauratrice aussi
appelée « colo-anale »
La résection avec anastomose colo-anale comporte une résection presque complète du rectum avec anastomose du côlon descendant à l'anus. La résection du mésorectum est complète.
Il est désormais établi qu'un réservoir en J (de 7 à 8 cm) doit être constitué pour restituer un volume et une compliance rectaux.
Cette intervention illustre les principes physiologiques qui sont testés par manométrie et testing préopératoire.
La fonction dépend de plusieurs facteurs:
|
· L’appareil résistif : sphincter anal interne, sphincter anal externe et pubo-rectal |
|
· L’appareil capacitif : compliance rectale |
|
· L’appareil propulsif : réflexe recto-anal inhibiteur, musculature pelvienne (abdominale ?) |
|
· La sensibilité |
4) Résection trans-anale
Chez les malades sélectionnés (petite tumeur superficielle – T1,2 N0 située entre 2 et 6 cm de la marge anale, ou vieillards chez lesquels la survie probable indépendamment de la lésion néoplasique ne dépasse pas quelques mois, etc...), une résection locale par voie trans-anale ou une destruction locale de la tumeur (par électro-coagulation, laser ou radiothérapie endo-cavitaire) est proposée.
Le tableau suivant résume les alternatives chirurgicales dans le cancer du rectum en fonction de la topographie et du stade TNM.
|
TECHNIQUE CHIRURGICALE
SELON LE NIVEAU DE LA LESION |
||
|
DISTANCE
/ LIGNE PECTINEE |
T1,
T2/N0 |
T3,
N1-3 |
|
10-15 cm au-dessus de la L.P. |
DW |
DW |
|
10 |
DW |
RMTA/ACA |
|
9 |
DW |
RMTA/ACA |
|
8 |
DW |
RMTA/ACA |
|
7 |
DW |
RMTA/ACA |
|
6 |
RTA/ACA |
ACA (APR) |
|
5 |
RTA/ACA |
ACA (APR) |
|
4 |
RTA/ACA |
ACA (APR) |
|
3 |
RTA/AAP |
AAP |
|
2 |
RTA/AAP |
AAP |
|
1 cm |
RTA/AAP |
AAP |
RTA = résection transanale
RMAT = résection mésorectale – anastomose trans-suturaire
DW = opération de DIXON-WANGENSTEEN
AAP = amputation abdomino-périnéale de MILES
ACA = résection mésorectale – anastomose colorectale
·
La préservation des
fonctions sexuelles
La
proximité des racines sacrées parcourant la concavité sacrée exige la
vigilance. En effet, la lésion iatrogène d’une racine unilatérale conduit à 50
% de perte de l’érection et 60 % de perte d’éjaculation ; en cas de
destruction bilatérale, prés de 100 % des patients perdent la possibilité
d’érection et 90 % n’ont plus d’orgasme.
La technique de résection mésorectale tient donc compte de ces éléments et exige la préservation des plexus nerveux par une technique soigneuse qui fait partie de l’enseignement de post-graduat.
B. LA CLASSIFICATION TNM
Tis: in situ
T1: invasion sous-muqueuse
T2: invasion de la musculeuse
T3: invasion de la sous-séreuse
T4: invasion du péritoine et/ou organes adjacents
N0: pas de métastase ganglionnaire
N1: max. 3 ganglions
N2: ³ 3 ganglions
M0: pas de métastase à distance
M1: métastases à distance
La profondeur de l'invasion va de Tis (in situ) à T4 (invasion du péritoine viscéral ou tissus adjacents). Elle conditionne la tactique chirurgicale et le pronostic. Dans un T4, il est rare de viser la guérison chirurgicale. Dans ce cas un traitement adjuvant est proposé. Les T1, T2 et T3 sont les meilleurs défis puisque la lymphadénectomie améliore la survie de même que l’âge du patient et l’expérience de chirurgien. Le taux de récidive varie de 15 à 60 % selon les analyses de fiabilité chirurgicale.
Le stade N est hautement corrélé avec la survie actuarielle.
L’analyse des ganglions présent dans la pièce de résection conditionne le pronostic. Si des progrès considérables ont été réalisés dans le bilan pré-opératoire, le rapport anatomo-pathologique post-opératoire reste la meilleure évaluation du traitement radiothérapique pré-opératoire, de la qualité de la résection chirurgicale (marges de résection et qualité de la lymphadénectomie) et donc du pronostic. Il détermine surtout pour les tumeurs coliques gauches et droites l’incitant à administrer du 5 fluoro-uracile et du ledervorin.
La présence de métastases doit être interprétée de manière chronologique.
Si, d’emblée, des métastases synchrones hépatiques, surrénaliennes, pulmonaires, sont découvertes, le clinicien est confronté à un cancer généralisé. L’attitude devient souvent palliative. Si, quelques moi ou années après l’exérèse d’un primitif, on diagnostique une métastase secondaire, l’attitude est radicalement différente. L’agressivité chirurgicale, couplée aux réponses à la radiothérapie de certaines métastases et à l’effet adjuvant de la chimiothérapie conforte l’idée de traiter les récidives et les localisations secondaires de manière multi-modale.
C. LE BENEFICE DE LA RADIOTHERAPIE PRE-OPERATOIRE (CANCER DU RECTUM)
La radiothérapie préopératoire diminue le risque de récidive locorégionale de manière plus importante que la radiothérapie postopératoire.
Elle est indiquée systématiquement (sauf si l'on n'a pas pu réaliser d'échoendoscopie rectale) en cas de tumeur envahissant toute la paroi (T3 ou T4) ou s'accompagnant de métastases ganglionnaires (N+).
D. LE BENEFICE DE LA CHIMIOTHERAPIE POST-OPERATOIRE SELON AGE ET STADE (CANCER DU COLON)
Un traitement au 5 FU associé au lévamisole augmente la survie pour les malades porteurs d'une tumeur de type T2,3 N1-3 ayant subi une résection colique.
E. LE TRAITEMENT DES PRESENTATIONS AIGUES
 Il s'agit de cancer colique ou rectal
obstructif, hémorragique ou perforé. Le
principe thérapeutique est d'enlever la lésion avec suture directe (cancer du
côlon droit ou transverse) ou éventuellement, dans certains cas de cancer du
côlon gauche ou du sigmoïde, de colostomie transitoire (intervention de
Hartman).
Il s'agit de cancer colique ou rectal
obstructif, hémorragique ou perforé. Le
principe thérapeutique est d'enlever la lésion avec suture directe (cancer du
côlon droit ou transverse) ou éventuellement, dans certains cas de cancer du
côlon gauche ou du sigmoïde, de colostomie transitoire (intervention de
Hartman).
En cas de tumeur rectale compliquée et inextirpable, on peut être amené à faire une colostomie en amont de la tumeur qui sera laissée en place.
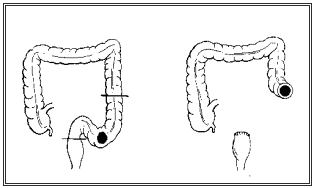 Une colostomie en canon de fusil doit
toujours être pratiquée dans ce cas, ce qui permet une vidange des segments
proximaux et distaux.
Une colostomie en canon de fusil doit
toujours être pratiquée dans ce cas, ce qui permet une vidange des segments
proximaux et distaux.
VI. PRONOSTIC ET SURVEILLANCE
La survie globale à 5 ans des malades opérés est de 50%.
Le degré de différentiation et d'infiltration de la tumeur dans la paroi est le facteur pronostique le plus important.
Le risque de survenue de polypes ou d'un second cancer colique chez les malades opérés est significatif La récidive peut être locorégionale et/ou viscérale ou à distance. Quoique le protocole idéal de surveillance reste à définir, les patients opérés d'un cancer du côlon ou du rectum doivent être surveillés par:
· examen clinique
· toucher rectal et échoendoscopie (en l'absence d'amputation abdomino-périnéale dans les tumeurs rectales opérées)
· échographie hépatique
· antigène carcino-embryonnaire (CEA)
· radiographie de thorax
· colonoscopie
CHAPITRE IX :
LA DIVERTICULOSE ET LA DIVERTICULITE DU COLON
Les diverticules du côlon sont des hernies de la muqueuse à travers les couches musculaires circulaires. Ils sont de petite taille et presque toujours multiples et préférentiellement localisés au niveau du côlon sigmoïde. Leur fréquence augmente avec l’âge (de ± 0% à 35 ans à ± 60% à 80 ans).
I. ANATOMOPATHOLOGIE
Les diverticules forment de petites dilatations sacculaires disposées en double file de part et d’autre de la musculaire mésentérique (taenia coli). La paroi diverticulaire est mince ; elle est constituée de muqueuse et de muscularis mucosae ainsi que d’une mince lamelle de sous muqueuse ; elle ne comporte pas de tunique musculaire.
La hernie diverticulaire s’effectue à travers la couche musculaire propre aux endroits de moindre résistance, c’est-à-dire aux points de passage des vaisseaux. Les diverticules communiquent avec la lumière intestinale par un collet étroit. La poche diverticulaire est en général remplie de débris alimentaires.
L’anomalie la plus frappante à l’ouverture du côlon porte sur le muscle qui est fortement hypertrophié. Les bandelettes externes (taenia coli) forment, à la section, une saillie blanchâtre, indurée, de consistance cartilagineuse tandis que les modifications de la couche musculaire interne provoquent l’accentuation de replis transversaux (haustrations) qui apparaissent comme des valvules rétrécissant la lumière intestinale.
L’inflammation du sac diverticulaire engendre une diverticulite et une péridiverticulite. En phase aiguë, il peut s’agir de véritables abcès coliques et péricoliques qui se perforent éventuellement, en péritoine libre ou dans un organe voisin. Le plus souvent, l’affection est chronique. La péridiverticulite induit une sclérolipomatose indurée, formant une gangue épaisse susceptible de provoquer des sténoses. Des adhérences avec les organes voisins peuvent se produire, elles se compliquent fréquemment de fistules.
Le riche réseau vasculaire péridiverticulaire lié à l’inflammation explique la possibilité de phénomènes hémorragiques se traduisant par des rectorragies.
II. PATHOGENIE
Bien que la pathogénie des diverticules soit encore incertaine, il paraît probable que ce soit la contraction interne et spastique de la musculature colique sur un résidu fécal insuffisant qui provoque la hernitation de la muqueuse à travers les couches musculaires.
L’âge et l’obésité sont probablement impliqués. Ils provoquent une fragilisation de la paroi colique à l’endroit de pénétration des vaisseaux. Mais le rôle le plus important semble être le régime alimentaire. L’incidence de la maladie a augmenté parallèlement aux perfectionnements des techniques utilisées par l’industrie alimentaire pour le blutage des farines. L’affection est rare dans les pays où la ration alimentaire est très riche en fibres végétales (Afrique). L’étude des populations migrantes a montré que, pour un groupe ethnique donné, l’incidence de la maladie augmente lors du passage d’un pays pauvre, où la part des végétaux dans la ration alimentaire est importante, vers un pays riche où la viande, les farines blutées et les conserves constituent l’essentiel de l’alimentation. L’affection est trois fois plus fréquente chez les non végétariens que chez les végétariens. Les régimes pauvres en résidus modifieraient la motricité colique, favorisant la formation de poches fermées et le développement d’hyperpressions endoluminales.
III. MANIFESTATIONS CLINIQUES ET DIAGNOSTIC
La grande majorité des malades porteurs de diverticules coliques sont asymptomatiques, l’affection étant découverte à l’occasion d’examens endoscopiques ou radiologiques réalisés pour des symptômes de colopathie. Chez ± 15% des malades, surviennent des complications : infections (diverticulite), sténoses et hémorragies.
1. La diverticulite
La stase fécale dans un diverticule ne communiquant avec la lumière colique que par un collet étroit, favorise le développement d’infections. Celles-ci atteignent le plus souvent plusieurs diverticules. Au niveau du segment colique de 10 à 20 cm, presque toujours sigmoïdien, la paroi colique s’épaissit par un œdème et hypertrophie musculaire. Le segment atteint est irrégulièrement rétréci. Des abcès intracoliques et péri-coliques se développent. Ces abcès peuvent se perforer vers les organes voisins (vessie, vagin, intestin grêle) ou vers le péritoine.
La symptomatologie est très variable et dépend de l’importance du processus suppuratif. On peut, très schématiquement, décrire trois aspects cliniques :
a. La sigmoïdite inflammatoire
Elle se manifeste par des douleurs abdominales d’intensité variable, localisées essentiellement dans la fosse iliaque gauche, associées à des troubles du transit (aggravation d’une constipation ou diarrhée). Un syndrome inflammatoire modéré peut être présent.
Une tomodensitométrie sera préférentiellement pratiquée comme premier examen complémentaire et montrera une inflammation de la graisse. Trois à quatre mois après l’épisode aigu, un lavement baryté est indiqué pour détecter les éventuelles séquelles chroniques (fistule ou sténose) et/ou un cancer sous-jacent.
b. La sigmoïdite abcédée
L’élément infectieux est très net (hyperthermie, hyperleucocytose). La douleur et les signes de subocclusion sont quasi constant. L’examen de la fosse iliaque gauche révèle l’existence d’une irritation péritonéale (défense, contracture, péritonisme). Une masse douloureuse est éventuellement palpable. Des symptômes urinaires (pyurie, pneumaturie), témoins d’une fistulisation vers la vessie, sont parfois observés. Une tomodensitométrie est le meilleur moyen diagnostique. Elle montrera les lésions abcédées coliques ou para-coliques. L’endoscopie et le lavement baryté sont contre-indiqués sauf si le doute concernant le diagnostic (cancer, colite) est tel qu’un examen endoscopique ou radiographique pourrait influencer l’attitude thérapeutique. Dans ce cas, un examen radiographique sous faible pression utilisant un produit de contraste hydrosoluble et/ou une endoscopie évitant l’insufflation seront réalisés. Dans tous les cas, une exploration complète radiologique du côlon sera réalisée 3 à 4 mois après traitement de phase aiguë.
c. La péritonite diverticulaire
Une péritonite généralisée peut survenir soit comme complication d’une sigmoïdite suppurée, soit par inflammation aiguë d’un seul diverticule. Des symptômes de péritonite généralisée apparaissent. Un état de choc se développe rapidement. Lorsque l’accident survient chez les vieillards, ce qui est souvent le cas, les signes cliniques d’irritation péritonéale sont peu évidents et on observe essentiellement un collapsus. Une radiographie de l’abdomen sans préparation montre, chez certains malades, la présence d’air libre dans le péritoine. Les examens radiologiques et endoscopiques sont contre-indiqués, à l’exception d’une tomodensitométrie et, dans certains cas, d’un lavement prudent réalisé au moyen d’un produit hydrosoluble.
2. L’obstruction
La présence d’une subocclusion n’est pas rare au cours des diverticulites. Une occlusion plus complète peut survenir et représenter l’élément dominant du tableau clinique. Les symptômes sont ceux de l’occlusion colique. L’endoscopie et la radiographie sont indispensables pour faire, avec certitude, le diagnostic différentiel entre occlusion diverticulaire et occlusion néoplasique. A la radiographie, la sténose diverticulaire est longue, effilée, les plis sont conservés et la présence de diverticules constante. La sténose néoplasique est courte, en trognon de pomme et les plis sont détruits (fig. 10).
Fig. 10. Sténose néoplasique (à gauche) et sténose diverticulaire (à droite)
3. L’hémorragie
Elle est classique mais rare. Nombre d’hémorragies basses autrefois attribuées à des diverticules sont la conséquence d’angiodysplasies coliques. Ces hémorragies contenant toujours du sang rouge, sont parfois de grande abondance. Le diagnostic sera établi par endoscopie et par artériographie. Contrairement à la diverticulite qui affecte le colon gauche, les hémorragies concernent le colon droit.
IV. TRAITEMENT
1. La diverticulose symptomatique
Le traitement est médical et essentiellement diététique. Il est basé sur le rôle attribué aux régimes pauvres en fibres végétales dans la genèse de l’affection. On conseille la prise régulière de son, ajouté soit à des céréales (gruau d’avoine par ex.), soit à des jus de fruits ou des potages de légumes. En vue d’éviter le ballonnement, on conseille de commencer par de petites quantités (5 g par jour), pour atteindre au moins la dose de 15 à 25 grammes par jour. Un effet similaire peut être obtenu avec du pain complet (minimum 150 g par jour). Lorsqu’une constipation persiste malgré ce régime, on conseillera des mucilages (psyllium par exemple). De la mébévérine sera prescrite en cas de douleurs. Les antibiotiques ne sont pas indiqués.
2. La sigmoïdite inflammatoire et abcédée
La majorité des malades sera traitée médicalement dans un premier temps. L’hospitalisation s’impose. Le traitement comporte le repos au lit, la diète et, à titre temporaire en cas de subocclusion, une aspiration gastrique. Des antibiotiques à large spectre seront administrés par voie intraveineuse.
En cas de douleurs importantes, on utilisera le paracétamol et la péthidine. Les opiacés sont contre-indiqués. En général, une amélioration est observée en quelques jours. La nutrition orale, reprise dès la disparition des signes d’infection aiguë et de subocclusion, comportera dans un premier temps un régime pauvre en déchets. A plus long terme, le régime sera enrichi en fibres.
Passé le premier épisode, deux situations peuvent se rencontrer :
a) La disparition des plaintes et une surveillance bisannuelle.
b) La persistance ou la récidive des symptômes, la présence de lésions coliques substénosantes ou la présence de fistules vers les organes voisins. En cas de plus de deux épisodes, on considère que l’indication de colectomie est posée. Celle-ci est proposée de manière élective et coelioscopique sans recours à l’anus artificiel.
3. La péritonite diverticulaire
L’indication chirurgicale est absolue et l’intervention doit être réalisée le plus rapidement possible, après application des mesures de réanimation usuelles. La région atteinte (en général, le côlon sigmoïde) sera réséquée et les abcès seront drainés. Une colostomie sera réalisée au moyen du côlon d’amont et le côlon sera fermé (opération de Hartmann). La continuité digestive sera rétablie quelques mois plus tard.
4. L’obstruction
Les subocclusions seront traitées médicalement. En cas d’occlusion totale, ne répondant pas au traitement médical, une intervention s’impose. Le schéma thérapeutique est analogue à celui décrit pour les cancers occlusifs (intervention en 2 temps). Les seules différences portent sur l’étendue de la résection et le délai entre l’intervention de dérivation et la résection (court en cas de cancer, long en cas de diverticulite).
5. L’hémorragie
Nombre de ces hémorragies s’arrêtent spontanément. Si l’hémorragie persiste, ou récidive, une résection s’impose. Une endoscopie et/ou une artériographie est indispensable pour localiser la source du saignement.
CHAPITRE X :
L’ISCHEMIE INTESTINALE
I. DEFINITION ET ETIOLOGIE
L’ischémie intestinale peut être due à des lésions vasculaires occlusives (artérielles ou veineuses) ou non occlusives (par diminution du débit sanguin local).
|
OCCLUSIVES (exemple : Ischémique mésentérique) |
NON OCCLUSIVES (exemple : Ischémie colique) |
|
A. ATHEROME B. EMBOLIE ARTERIELLE · Rétrécissement mitral · Troubles du rythme cardiaque · Endocardites bactériennes · Thrombus mural de l’infarctus du myocarde C. THROMBOSE VEINEUSE · Contraceptifs oraux · Infection (appendicite) · Stase mécanique · Hypercoagulabilité primaire (25 à 55%) |
A. CHUTE DU DEBIT · Collapsus (choc) · Vasoconstriction splanchnique B. ATTEINTE DISTALE · Maladie de système (PAN, LED) · Radiothérapie · Chlorure de potassium C. AUGMENTATION DE LA PRESSION INTRALUMINALE · Compression pariétale en amont d’un obstacle (ex. : tumeur) |
Les lésions les plus fréquentes sont l’ischémie colique aiguë (60%) et l’ischémie grêle ou mésentérique aiguë (30%). L’ischémie mésentérique chronique est beaucoup plus rare (<5%).
II. FORMES FREQUENTES D’ISCHEMIE INTESTINALE
A. L’ISCHEMIE COLIQUE
C’est une anoxie du côlon.
1. Anatomopathologie
a. Macroscopie
Dans les premiers temps (moins de deux semaines), le segment du côlon atteint est dilaté, congestif, de coloration foncée ; la muqueuse y est oedématiée et friable. Parfois, l’œdème massif se dispose en larges placards correspondant à ce qui est décrit en radiologie comme des « empreintes de pouce ». Cette muqueuse s’ulcère facilement donnant naissance à une membrane grisâtre qui adhère à la surface. Elle peut aussi être tapissée par des magmas de matériel nécrotique ou par des pseudo-polypes inflammatoires.
Ultérieurement, les lésions se détergent. Suivant la profondeur de l’atteinte, l’évolution se fait vers la réparation ad integrum de la muqueuse ou vers des lésions pariétales chroniques sous forme d’ulcérations à fond fibreux ou de zones sténotiques.
b. Microscopie
Les différentes structures histologiques de la paroi se nécrosent à des degrés divers. La muscularis mucosae est résistante à l’anoxie et constitue un excellent point de repère.
Dans les phases précoces, les cryptes sont intactes et seul le chorion est oedématié et hémorragique. Ultérieurement, l’épithélium cryptique se nécrose, mais le plus souvent, les lésions restent limitées à la partie superficielle qui est dépeuplée de cellules tandis que des cellules viables persistent au fond des cryptes. C’est à partir de ces dernières que s’effectuera la régénération éventuelle du tissu. Si la nécrose s’étend à toute la hauteur de la muqueuse, les cryptes déshabitées se collabent, laissant en place une muqueuse d’apparence « fantomatique » (aspect en cité morte). L’architecture de la trame réticulée persiste longtemps et est reconnaissable par des colorations spéciales.
Les ulcères (atteinte dépassant la muqueuse) sont tapissés par du tissu de granulation. Les vaisseaux sont dilatés, de l’hémosidérine peut se retrouver dans le chorion.
2. Manifestations cliniques
Le malade présente des douleurs brutales en général dans la fosse iliaque gauche et des rectorragies le plus souvent dans un contexte de terrain vasculaire. A la palpation, l’abdomen est douloureux mais souple.
3. Diagnostic
L’ischémie colique frappe surtout l’angle splénique, le côlon descendant et le sigmoïde.
L’abdomen à blanc montre parfois des images en empreinte de pouce. Le lavement baryté (gastrographine, simple contraste) montre des ulcères et des empreintes de pouce. L’artériographie n’a que de très rares indications.
Une coloscopie sera pratiquée s’il n’y a pas de signes péritonéaux. Elle montrera une atteinte segmentaire avec des ulcérations et des protrusions hémorragiques. Elle sera complétée par un examen histologique (biopsies).
4. Evolution
Les lésions hémorragiques sous-muqueuses et les ulcérations superficielles évoluent vers la guérison (50% des cas). Les lésions plus profondes se compliquent de nécroses et de perforations aiguës ou de sténoses d’installation plus lente.
5. Traitement
Le traitement de l’ischémie colique est en général conservateur avec suivi clinique et morphologique (abdomen à blanc, coloscopie ou lavement baryté). Les mesures auront été prises au préalable pour réduire la cause déclenchante ou traiter l’affection de base (ex. : vasculite).
B. L’ISCHEMIE MESENTERIQUE AIGUE
C’est une anoxie du grêle.
L’ischémie mésentérique aiguë se manifeste par des douleurs abdominales d’apparition brutale et souvent très intenses. Ces douleurs s’accompagnent parfois de diarrhée sanglante.
A l’examen physique, on observe des signes d’irritation péritonéale et un iléus paralytique complet. Un état de choc apparaît rapidement.
Comme dans la colite ischémique, cette symptomatologie apparaît dans un contexte de pathologie vasculaire périphérique : sujet âgé artérioscléreux, maladie mitrale, etc.
Les examens biologiques montreront une augmentation des leucocytes et des LDH.
L’imagerie se limitera souvent à la réalisation d’un abdomen à blanc (aérogrélie, iléus paralytique, épaississement irrégulier des anses intestinales, pneumopéritoine). Chez certains malades on réalisera une tomodensitométrie pour exclure une autre pathologie abdominale. Une angiographie permettra de distinguer les formes occlusives des formes non occlusives. Cet examen n’est justifié que s’il est réalisé dans de bonnes conditions et avant l’apparition des signes d’irritation péritonéale.
Le traitement est le plus souvent chirurgical et doit être pratiqué rapidement. Après une brève réanimation (aspiration gastrique, rétablissement de la masse sanguine, antibiotiques), on réalisera une laparotomie. Les zones nécrosées seront réséquées. Dans certaines circonstances, on réalisera une revascularisation du grêle ischémique mais non nécrosé par embolectomie, endartériectomie ou pontage. Il est souhaitable de conserver le plus d’intestin possible. Les sutures seront parfois réalisées dans un terrain dont la vascularisation reste incertaine. Dans ce cas, il est de coutume de réexplorer, de principe, l’abdomen 48 heures après la résection-suture.
C. L’ISCHEMIE MESENTERIQUE CHRONIQUE (ANGOR ABDOMINAL)
L’angor abdominal est rare. Au moins deux des trois troncs vasculaires principaux doivent être sténosés à plus de 50%.
Il se manifeste par des douleurs abdominales survenant 10 à 30 minutes après le repas. Ces douleurs sont irradiées dans tout l’abdomen et dans le dos. Un amaigrissement survient par restriction alimentaire.
Le diagnostic est angiographique (clichés de profil).
Le traitement est chirurgical : endartériectomie, pontage.
CHAPITRE XI : DIVERS
I. LES ENTEROSTOMIES
Les entérostomies sont souvent mal supportées psychologiquement. Il est donc indispensable d'exposer au malade les moyens permettant de s'adapter à cette situation nouvelle et de l'aider par des conseils durant la période d'adaptation.
1. Soins locaux (fig. 11)
Du matériel à usage unique sera prescrit. Il comporte un disque adhérant (Karaya, Stomohésive) placé autour de l'entérostomie et une poche recueillant les selles. Suivant le matériel choisi par le malade, le disque sera renouvelé tous les 5 à 6 jours, la poche une ou plusieurs fois par jour, ou l'ensemble, disque et poche, sera remplacé quotidiennement. Le port d'une ceinture évitant le déplacement de la prothèse n'est plus indispensable. L'hygiène locale doit être stricte mais réalisée avec des détergents ordinaires. Les lésions cutanées, dues au contact occasionnel de la peau avec les selles, seront traitées par une solution aqueuse d'éosine à 2%.
Fig. 11 Appareillage d'une colostomie (à gauche) et technique du lavement par la colostomie (à droite)
2. Règles hygiéno-diététiques
La grande majorité des entérostomisés peuvent mener une vie normale. Les bains et douches sont permis. La pratique des sports est possible, les sports violents étant toutefois déconseillés. Les voyages sont permis pour autant que le malade se munisse du matériel indispensable (poches).
Les prothèses modernes sont quasi invisibles sous les vêtements et il est rare que l'odeur des selles soit perceptible par l'entourage. L'émission incontrôlée de gaz constitue par contre souvent une gêne. Les troubles sexuels ne sont pas rares. Ils sont presque toujours d'origine psychique et peuvent nécessiter un support psychothérapique.
Aucun régime n'est en principe nécessaire. On conseillera toutefois au malade d'éviter les aliments ayant tendance à augmenter le volume et la fréquence des selles (légumes et fruits riches en fibres) ou augmentant la production de gaz (pois et fèves). Les écarts de régime auront pour seule conséquence une modification du volume et de la consistance des selles.
3. Continence
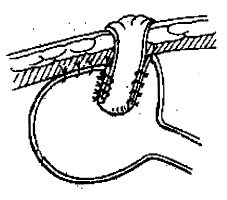
Plusieurs artifices techniques visant à créer des entérostomies continentes ont été proposés.
Pour les iléostomies, KOCH a proposé de construire, au moyen de l'anse grêle terminale, une poche terminée par une valve. La poche doit être vidée régulièrement par introduction d'une sonde. La technique est de réalisation délicate et des inflammations de la poche surviennent (fig 12).
Fig. 12
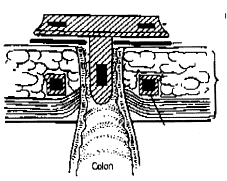
Pour les colostomies un anneau aimanté est placé autour de la colostomie. Une plaque métallique amovible est placée sur la colostomie assurant ainsi la continence (fig. 13).
Fig. 13
Aucune de ces techniques n'est à l'abri des complications.
La majorité des malades colostomisés peut apprendre à s'administrer des lavements de 700 à 1000 ml d'eau tiède par la colostomie au moyen d'un matériel à usage unique spécialement conçu dans ce but (figure 7). Il n'y a, en général, pas d'émission de selles pendant les 48 à 72 heures qui suivent, ce qui assure un confort remarquable.
4. Complications
Les principales complications des entérostomies sont la sténose et le prolapsus. Les sténoses seront contrôlées par des dilatations. Les prolapsus nécessitent souvent des réinterventions.
II. LES VOLVULUS
Le volvulus du côlon résulte de la rotation d’un segment colique autour de son axe mésentérique, produisant une obstruction partielle ou complète de la lumière. Différents degrés de délabrement vasculaire du segment intestinal sont produits par la torsion de la racine du mésentère et, secondairement, par la distension progressive de l’anse tordue, ce qui peut conduire à la nécrose et à la perforation.
Le volvulus apparaît surtout au niveau du sigmoïde (85%) plus rarement au niveau du caecum.
1. Le volvulus sigmoïdien
Le volvulus sigmoïdien se produit principalement chez des sujets âgés. Une anse sigmoïdienne longue attachée à un mésentère court est, en général, la cause du volvulus.
Les symptômes sont ceux de l’occlusion colique gauche : douleur crampoïde localisée dans la fosse iliaque gauche ou la région sus-pubienne, arrêt des gaz et des matières fécales, ballonnement et hyper-péristaltisme. Plus tard, apparaissent des vomissements alimentaires puis fécaloïdes.
La radiographie de l’abdomen sans préparation montre très souvent une image en besace, les deux extrémités de l’anse volvulée plongeant dans le petit bassin. Le diagnostic sera confirmé par lavement à la gastrofrafine (image en bec de flûte).
Le volvulus doit être réduit le plus rapidement possible car la torsion des vaisseaux entraîne un risque de gangrène et de péritonite fécale. L’introduction d’une sonde dans le segment volvulé permettant à l’air et aux liquides de s’échapper, entraîne très souvent la réduction spontanée du volvulus. Cette manœuvre se fera préférentiellement par endoscopie. La réalisation d’un largement à la gastrofraine entraîne parfois la réduction du volvulus. En cas d’échec des manœuvres endoscopiques et radiologiques ou s’il apparaît des symptômes laissant suspecter une nécrose colique, une intervention s’impose. Suivant les cas, on réalisera soit une simple dévolvulation avec fixation du côlon, soit une dévolvulation complétée par une colostomie ou une colectomie.
Le volvulus sigmoïdien étant dû à une cause anatomique, il a tendance à récidiver. Les pexies coliques (fixations) sont peu efficaces. Une colectomie réalisée « à froid » sera proposée chez la majorité des malades.
2. Le volvulus caecal
Le volvulus caecal n’est possible que si le caecum, l’iléon terminal et le début du côlon ascendant sont fixés trop lâchement à la paroi abdominale postérieure.
Les manifestations cliniques sont celles de l’obstruction aiguë de l’intestin grêle.
La radiographie sans préparation de l’abdomen est souvent pathognomonique. Il montre une image centro-abdominale ou sous-phrénique gauche et une fosse droite déshabitée.
L’intervention chirurgicale est pratiquée dès que possible : réduction du volvulus et fixation du caecum à la paroi postérieure de l’abdomen. L’hémicolectomie droite est nécessaire si les lésions causées par l’ischémie sont importantes.
III. L’ANGIODYSPLASIE
Les angiodysplasies sont des lésions artério-veineuses localisées atteignant principalement le caecum et le côlon ascendant. Histologiquement, elles sont formées de foyers d’ectasies capillaires et veineuses. Il convient de distinguer les angiodysplasies de la maladie de Rendu Ossler. Cette dernière a un caractère familial et des lésions sont présentes au niveau de toutes les muqueuses.
L’angiodysplasie, longtemps asymptomatique, se manifeste entre 40 et 80 ans par des hémorragies digestives basses récidivantes et, parfois, très importantes. Elle est associée dans ¼ des cas à une atteinte de la valvule aortique. Le diagnostic sera posé par endoscopie (ectasies veineuses) et artériographie (présence de pelotons vasculaires et d’un retour veineux précoce). Le traitement est généralement endoscopique (électrocoagulation). Une embolisation par cathétérisme de l’artère nourricière sera proposée dans certains cas. En cas d’échec de ces méthodes une résection de la zone colique porteuse sera proposée.
IV. L’ENDOMETRIOSE COLIQUE
Elle se localise essentiellement sur les viscères du petit bassin et, en particulier, sur le sigmoïde. Des lésions analogues sont observées, quoique plus rarement, au niveau du caecum ou du grêle. Des tumeurs kystiques, évoluant suivant le cycle menstruel, se développent. Elles peuvent provoquer des sténoses coliques partielles.
La symptomatologie clinique est analogue à celle des autres sténoses coliques et notamment du cancer. Son apparition chez une femme entre 30 et 40 ans doit faire penser à l’endométriose colique, surtout s’il existe une dysménorrhée associée. Une petite hémorragie intestinale le premier jour des règles est un élément important en faveur du diagnostic, mais ce symptôme est rarement présent. La majorité des hémorragies digestives observées dans l’endométriose est due à une lésion associée qu’il convient de chercher.
Le diagnostic d’endométriose colique sera confirmé par l’endoscopie et la radiographie. On constatera la présence d’une sténose, mais les plis muqueux seront conservés. Une évolutivité des lésions en fonction du cycle menstruel peut être observée. Les biopsies seront en général négatives. Le traitement sera celui de l’endométriose (cf. Gynécologie). Une intervention chirurgicale sera proposée en cas de sténose serrée ou lorsqu’il existe un doute diagnostique.
V. LE DIVERTICULE DE MECKEL
Anomalie congénitale observée chez environ 1% des sujets, reliquat du canal omphalo-mésentérique, le diverticule de Meckel siège à environ 75 cm de la valvule iléo-caecale sur le bord antimésentérique de l’iléon. Dans sa paroi habituellement constituée de muqueuse de type grêle, peuvent se développer des foyers hétérotopiques de muqueuse gastrique responsables d’hémorragies digestives.
Cliniquement silencieux dans la majorité des cas, il peut être responsable d’obstruction, d’inflammations associées éventuellement à une perforation. Le développement de tumeurs malignes (carcinoïdes notamment) est très rare.
En présence d’une hémorragie digestive survenant chez un sujet jeune, une investigation au technétium99 permettra le plus souvent la mise en évidence du diverticule, à la suite de la captation de cet isotope par la muqueuse gastrique hétérotopique.
L’inflammation du diverticule de Meckel prête le plus souvent à confusion avec une appendicite aiguë (voir cinquième partie).
VI. L’INVAGINATION INTESTINALE
Fréquente chez l’enfant en-dessous de 2 ans, l’invagination intestinale est exceptionnelle chez l’adulte. Contrairement à la lésion observée chez le jeune enfant, où elle est presque toujours idiopathique, l’invagination de l’adulte est dans plus de 90% des cas, secondaire à une lésion préexistante, en général, une tumeur bénigne ou maligne.
L’invagination de l’adulte se manifeste essentiellement par des symptômes de subocclusion grêle. Du méléna est observé dans 30% des cas. Le lavement baryté montre, mais d’une manière inconstante, l’image caractéristique de la tête d’invagination.
L’invagination de l’adulte est une indication opératoire formelle puisqu’il y a une lésion causale dans la majorité des cas. La désinvagination par lavement ne doit pas être tentée car elle est souvent suivie de perforation.
VII. LA PNEUMATOSE KYSTIQUE
La pneumatose kystique est une maladie rare, bénigne, caractérisée par le développement de multiples kystes aériques sous-muqueux ou sous-séreux. L’aspect macroscopique et endoscopique du côlon rappelle celui observé dans la polypose. La biopsie d’un de ces « polypes » provoque en général son affaissement. La nature kystique et aérique des lésions peut être mise en évidence radiologiquement. Cette affection ne nécessite, en général, aucun traitement.
CHAPITRE XII :
APPROCHE CLINIQUE DES MALADIES INTESTINALES
|
Ce
chapitre est uniquement destiné à la préparation des exercices |
I. APPROCHE DE LA DIARRHEE CHRONIQUE
Pour affirmer la présence d’une diarrhée chronique, il faut qu’elle évolue depuis 4 à 6 semaines.
Les fausses diarrhées se caractérisent par une augmentation de la fréquence des selles sans modification de consistance ou de poids (< 200 g). On les trouve dans le côlon irritable, le fécalome et l’incontinence anale.
L’hypersécrétion muqueuse qui est également une fausse diarrhée est parfois présente dans les tumeurs villeuses ou les cancers du rectum et les entérocolites inflammatoires.
Après avoir éliminé les fausses diarrhées, le but de la démarche diagnostique est de préciser :
· ses mécanismes (souvent associés)
· sa cause.
A. APPORT DE LA CLINIQUE
Les premières questions à se poser sont : la diarrhée est-elle organique ou fonctionnelle, la diarrhée est-elle colique ou grêle ?
|
|
ORGANIQUE |
FONCTIONNELLE |
|
Durée de la maladie Rythme journalier Symptômes associés ¯ poids, signes extra int. Aspect des selles Poids des selles |
Récente (< 1 an) Nocturne +++ Mucus + sang pus Stéatorrhée > 200 gm |
Ancienne (> 1 an) Matinale Pas nocturne Post stress 0 Mucus < 200 g |
|
DIARRHEE COLIQUE (90%) |
DIARRHEE GRELE (10%) |
|
Fréquente Petites quantités de selles émises fréquemment avec sensation de ténesme Présence de mucus et/ou de sang Douleur sus-pubienne Douleur abdominale soulagée par l’émission de selles |
Rare Selles volumineuses, peu fréquentes sans ténesme Ni mucus ni sang Douleur péri-ombilicale Douleurs abdominales non soulagées par l’émission de selles. |
B. APPORT DES EXAMENS PARACLINIQUES
1) Affirmer la diarrhée (> 300 g/24 h) et exclure une fausse diarrhée
2) Examens biologiques de base :
Ex hématologique Selles :
Protéines + électrophorèse Leucocytes
Fer et transferrine Œufs et parasites
Tests inflammatoires Soudan III
Ions Sang occulte
½
Clinique évoquant une affection du grêle Clinique évoquant une affection du côlon
Soudan + Tests inflam. Soudan – Tests inflam. +
Carences biologiques
¯ ¯
Oesogastroduodénoscopie : Coloscopie totale + iléoscopie
Biopsie : AnaPath et Microbio Biopsies
Aspiration : Microbio
Si toujours pas de diagnostic :
Analyse des selles de 24 heures (2 à 3 fois)
(sous régime riche en graisses)
Dosage des graisses
Dosage du Na et K
Clairance a1 antitrypsine
½
Graisses > 7 g/24 h Graisses < 7 g/24 h
¯ ¯
STEATORRHEE DIARRHEE SANS STEATORRHEE
![]()
![]()
MALABSORPTION MALDIGESTION EXSUDATIVE SECRETOIRE MOTRICE OSMOTIQUE
M.
cœliaque Panc.
chronique Colite ulcérée Tum. à VIP Post gastrec. Déficit
lactase
II. APPROCHE DES DIARRHEES AIGUES
DIAGNOSTICS DIFFERENTIELS :
ENTEROCOLITE INFECTIEUSE
Non invasive (Entérotoxiques et cytopathologiques)
Invasive.
ENTEROCOLITE MEDICAMENTEUSE
COLITE ISCHEMIQUE
PREMIERE POUSSE D’ENTEROCOLITE IDIOPATHIQUE
FAUSSE DIARRHEE
1. La diarrhée aiguë est-elle infectieuse ?
On se basera sur les éléments suivants :
a) La clinique
· évolution transitoire < 1 mois
· antécédents de voyages
· toxi-infection alimentaire collective ou sporadique
· prise récente d’antibiotiques.
b) La microbiologie
· examen des selles : œufs, parasites, leucocytes fécaux, coproculture
· hémocultures
· sérologie (yersinia, salmonella, amibiase, bilharziose)
· aspirations et biopsies endoscopiques (examen direct et culture)
c) L’endoscopie
· halo érythémateux intense
· colite pseudo-membraneuse
· ulcères amibiens.
d) L’histologie
· architecture des cryptes conservée
· inflammation à polymorphonucléaires
· caractérisation du germe ou du parasite
2. La diarrhée aiguë infectieuse est-elle due à des germes invasifs ou non invasifs ?
|
|
||
|
Causes Atteinte Mécanisme Présentation clinique Leucocytes fécaux |
Shigella, Salmonella Clostridium difficile Yersinia, Amibiase Colique Atteinte de la muqueuse Diarrhée sanglante Douleurs abdominales Selles de petit volume Température +++ |
E. coli toxigénique Virus Lamblia Grêle Diarrhée sécrétoire sans lésion muqueuse Diarrhée aqueuse non sanglante Nausées vomissements Selles volumineuses Apyrexie habituelle 0 |
3. Qui investiguer ?
Il faut investiguer les patients présentant :
· une diarrhée sanglante
· une diarrhée de plus de 5 jours
· une fièvre élevée > 39°
· des douleurs abdominales importantes
· des signes d’hypovolémie
· des tares associées
4. Quels examens demander ?
(a) Biologie: formule sanguine, ions
(b) Examen des selles (fraîches !)
· Recherche de leucocytes, d’œufs et de parasites (selles fraîches)
· Coproculture (s’il y a un délai entre l’émission et l’examen bactériologique demander un milieu spécial)
· ! préciser la demande en cas de recherche de C. difficile ou de E. coli toxigénique
· ! La coproculture est négative dans près de 40% des cas de diarrhée infectieuse.
(c) Endoscopie
· Rectosigmoïdoscopie ou coloscopie totale prudente si les cultures sont négatives pour obtenir le diagnostic différentiel. Obtention de matériel (frottis, aspirations, biopsies) pour l’analyse microbiologique, virologique et anatomo-pathologique.
· Gastroduodénoscopie avec biopsie et aspiration du suc duodénal pour recherche de lamblia, strongyloïdes et cryptosporidium.
(d) Sérologie
· Yersinia, Salmonella, Amibiase, Bilharziose.
(e) Hémocultures
5. Qui traiter ?
Les facteurs de risque indiquant un traitement ATB sont :
· une température élevée
· une septicémie
· une diarrhée sanglante par germes invasifs
· la présence de prothèses vasculaires
· les patients âgés, fragilisés ou immunodéprimés
6. Quel traitement ?
· Eau, sucre, sel, ions (solution ORS) si déshydratation
· Eviter le lactose, le sorbitol (chewing-gum)
· Prescrire du lopéramide (Imodium® en cas de douleurs et en l’absence d’une diarrhée sanglante et des levures (Perentérol®) dont l’effet est antisécrétoire et trophique sur la muqueuse intestinale.
· Administrer des antibiotiques si facteurs de risque
Bactéries : fluoroquinolones (5 à 7 jours)
Amibiase : metronidazole (10 j) puis amaoebicide de contact.
7. Le problème de la « diarrhée du voyageur »
La « diarrhée du voyageur » atteint 30 à 60% des individus indemnes arrivant en pays tropical ou tempéré chaud.
Les étiologies les plus fréquentes sont :
· E. coli toxigénique, Salmonella, Shigella
· Rotavirus
· Parasites.
Les symptômes surviennent entre le quatrième et le quatorzième jour après l’arrivée. Ils comportent de la diarrhée, des nausées, des douleurs abdominales mais en général peu ou pas de température. L’évolution est en général spontanément résolutive en 4 à 7 jours.
Un traitement ne doit être entrepris que si la diarrhée est sévère et sanglante. Il comporte un traitement antibiotique empirique (fluoroquinolones) pendant 5 à 7 jours. En cas de persistance des symptômes il est impérieux de faire des analyses de selles.
La prophylaxie comporte essentiellement des règles hygiéno-diététiques. Un traitement préventif par des Quinolones sera envisagé chez les sujets à risque (patients porteurs de colites inflammatoires, diabétiques, malades traités par des diurétiques ou des digitaliques) et, éventuellement, chez les hommes d’affaires et les sportifs.
III. APPROCHE CLINIQUE DU CONSTIPE
|
Anamnèse Examen physique Toucher rectal Anuscopie |
||
|
Symptômes récents OUI |
Symptômes récents NON |
|
|
Hémato, VS, CRP Ionogramme, Ca++ Tests thyroïdiens Glycémie Coloscopie ou L.B. (si >
50 ans) |
Constipation probablement
hypotonique ou spastique ¯ TRAITEMENT D’EPREUVE (2 mois) Fibres, son, mucilages, laxatifs huileux ou osmotiques Boissons abondantes Exercices physiques Se présenter à selle à
heure fixe ¯ Pas d’effet (20%) ¯ Schéma d’investigation A |
Constipation probablement
terminale ¯ TRAITEMENT D’EPREUVE (2 mois) Suppositoires de glycérine Petits lavements (Fleet*) ¯ Pas d’effet ¯ Schéma d’investigation B |
|
APPROCHE DU
PATIENT CONSTIPE REFRACTAIRE |
|||
|
SCHEMA D’INVESTIGATION A |
SCHEMA D’INVESTIGATION B |
||
|
Temps de transit colique |
|
||
|
Normal ¯ Enquête psychologique |
Inertie colique ¯ Continuer et adapter le traitement précédent Ajouter du Cisapride Très exceptionnellement : colectomie totale après avoir exclu une composante terminale |
Constipation terminale ¯ Schéma d’investigation B |
Défécographie Manométrie anorectale Electromyographie Echographie transrectale ¯ Diagnostic et traitement spécifique (page suivante) |
|
DIAGNOSTIC ET
TRAITEMENTS SPECIFIQUES DES CONSTIPATIONS TERMINALES |
||
|
AFFECTION |
TESTS DIAGNOSTIQUES |
TRAITEMENT |
|
Plancher
pelvien spastique Maladie de Hirschsprung Mégarectum acquis |
Manométrie Absence de relaxation du sphincter externe pendant
l’effort défécatoire Défécographie Empreinte sur le mur postérieur du rectum, d’autant
plus nette que la contraction du muscle pubo-rectal est importante,
entraînant une fermeture de l’angle ano-rectal au lieu de son ouverture
normalement observée Manométrie Abolition du réflexe recto-anal inhibiteur Hypertonie
sphinctérienne Lavement baryté Biopsies profondes du rectum Défécographie Rectum
large et atone Vidange
incomplète Manométrie compliance du rectum |
Biofeedback Résection du segment
aganglionnaire Biofeedback |
IV. LES HEMORRAGIES DIGESTIVES BASSES
Le mélaena est une émission de sang noir par l’anus. Son origine se situe en général au niveau de la partie proximale du tube digestif et des glandes annexes (foie, pancréas) ou du côlon droit si le transit est lent. Des selles noires peuvent également être observées après administration de Fe, de Bismuth, de charbon ou après ingestion d’épinards. La rectorragie ou hémochézie est une émission de sang rouge ou rouge foncé par l’anus. L’origine est en général distale, mais les hémorragies d’origine haute peuvent donner les rectorragies si le saignement est abondant.
|
LESIONS ANALES · Hémorroïdes · Fissures anales · Prolapsus rectal · Tumeurs anales LESIONS RECTO COLIQUES · Tumeurs bénignes · Tumeurs malignes · Diverticules · Angiodysplasie, Malade de Rendu Ossler · Recto colite ulcérohémorragique · Colite ischémique · Colite radique · Corps étrangers, Ulcération thermométrique LESIONS GRELES · Infarctus mésentérique · Diverticule de Meckel · Tumeurs (malignes) · Invagination intestinale LESIONS PROXIMALES · Cf. hémorragies digestives hautes |
|
ANAMNESE – EXAMEN PHYSIQUE – TOUCHER RECTAL BIOLOGIE – ECG – Rx THORAX REANIMATION ¯ OESOGASTRODUODENOSCOPIE ¯ Si négative ¯ RECTO SIGMOIDOSCOPIE ¯ Si négative ¯ |
||
|
|
HH SEVERE PERSISTANTE (15%) |
ARRET SPONTANE (80%) |
|
|
|
|
|
|
|
ENTEROSCOPIE TRANSIT SCINTIGRAPHIE (Meckel, GR*) SI COLO NÉGATIVE |
|
LAPARO CHIRURGICALE ET ENTEROSCOPIE
PEROPERATOIRE |
|
|
V. LES ANEMIES D’ORIGINE DIGESTIVE
A. ANEMIES PAR CARENCE MARTIALE
1. Etiologies
|
1. OESOPHAGE – ESTOMAC – DUODENUM · Œsophagites · Gastrites érosives (AINS) · Ulcère gastro-duodénal · Tumeurs 2. GRELE · Tumeurs · Malade de Crohn · Maladie cœliaque · AINS · Diverticule de Meckel · Angiodysplasie 3. COLON · Polypes · Cancers (côlon droit principalement) · Maladie de Crohn, colite ulcéreuse · Angiodysplasie Remarque : les hémorroïdes ne donnent que rarement une anémie. La diverticulite colique provoque des hémorragies actives, mais pas d’anémie. |
2. Biologie clinique
|
|
Carence en fer |
S. inflammatoire sans composante ferriprive |
S. inflammatoire avec composante ferriprive |
|
Fe |
¯ |
¯ |
¯ |
|
Transferrine (TF) |
|
¯ |
¯ |
|
Saturation TF |
< 15% |
> 15% |
< 15% |
Examen hématologique : microcytose.
3. Plan d’investigation
A l’interrogatoire, on cherchera les antécédents de gastrectomie, de polype ou de cancer colique, la prise d’AINS ou d’anticoagulants, les ménorragies, les troubles nutritionnels.
A l’examen physique, outre le toucher rectal on relèvera les signes d’hypertension portale et les télangiectasies (présentes dans la maladie de Rendu-Ossler).
La séquence des examens para-cliniques sera la suivante :
1. Coloscopie totale + oesophago-duodénoscopie (le même jour)
2. Si ces examens sont négatifs : transit grêle
3. Si cet examen est négatif : entéroscopie et/ou angiographie mésentérique
4. Si cet examen est négatif : entéroscopie per-opératoire.
En cas de suspicion de diverticule de Meckel, on peut faire une scintigraphie au pertechnétate.
4. Traitement
· Traitement causal
- Electrocoagulation ou photocoagulation endoscopique
- Polypectomie
- Résection colique
· Thérapeutique martiale
- Sous surveillance clinique et biologique.
B. ANEMIES PAR CARENCE EN VITAMINE B12 ET/OU FOLATES
1. Etiologies
|
־ Vitamine B12 |
־ Folates |
|
Gastrite atrophique auto-immune Gastrectomie totale Maladie de Crohn, résection du grêle, stéatorrhée, pullulation microbienne Carences alimentaires Besoins äö grossesse, thyréotoxicose |
Ethylisme chronique Malabsorptions Déficit nutritionnel Médicaments : antifolates, anticonvulsivants, salazopyrine Gastrectomie subtotale Besoins öä : grossesse, croissance |
2. Diagnostic
Ex. hématologique : macrocytose
Dosage vit. B12 et Folates
Test de
Schilling.
1. Traitement
Vitamine B12 : Hydroxycobalamine : 1000 g/2 j, IM, pendant 2 mois. Un traitement d’entretien (1000 g/mois) est indispensable en cas de gastrite atrophique auto-immune ou de gastrectomie totale).
Acide folique : 5 à 15 mg/24 h, 3 semaines à 3 mois.
CHAPITRE XIII : L’APPENDICE
I. L’APPENDICITE AIGUE
A. ETIOLOGIE
Soixante pour-cent des appendicites aiguës résultent d’une obstruction de la lumière appendiculaire. Cette occlusion peut être due à :
· un fécalome (le plus souvent)
· un corps étranger (noyau de fruit, ...)
· des vers intestinaux (oxyures)
· une tumeur
· un étranglement par une structure fibreuse
· une hyperplasie de follicules lymphoïdes (crise d’appendicite aiguë apparaissant au cours d’une angine par exemple).
Pour les 40% des appendicites qui restent, l’étiologie est mal connue.
B. ANATOMOPATHOLOGIE – EVOLUTION
L’obstruction de la lumière appendiculaire provoque la multiplication des germes présents, de l’œdème et une distension de l’organe. A ce stade, les lésions sont encore réversibles. Si l’évolution se poursuit, les germes envahissent la paroi appendiculaire et provoquent la nécrose purulente de celle-ci : un abcès intra-appendiculaire se forme. Par suite de la distension progressive de l’appendice, de l’invasion microbienne et de l’altération de la circulation locale, une perforation peut se produire. La perforation évolue rapidement, en l’absence de traitement, vers la péritonite généralisée ou vers l’abcès péri-appendiculaire.
C. MANIFESTATIONS CLINIQUES
1. Forme clinique habituelle
a. Interrogatoire
La distension de l’appendice stimule les terminaisons nerveuses des fibres viscérales afférentes produisant une douleur vague, diffuse, sourde dans la région épigastrique ou péri-ombilicale (douleur reportée) souvent accompagnée de nausées et de vomissements.
Lorsque l’inflammation s’étend au péritoine pariétal, il se produit un déplacement caractéristique de la douleur vers la fosse iliaque droite (douleurs péritonéales à localisation topographique). Cette douleur est augmentée par la toux et les mouvements.
b. Examen physique
La température dépasse rarement 38,5° et est accompagnée d’une tachycardie proportionnelle à son élévation. L’examen de l’abdomen montre la présence d’une zone limitée électivement douloureuse à la palpation dans la fosse iliaque droite. La localisation exacte (point de Mac Burney, de Lanz, etc.) de cette zone n’a que peu d’importance. La contracture, la défense abdominale, le péritonisme et l’hyperesthésie cutanée localisées à la fosse iliaque droite révèlent la présence d’une irritation péritonéale. Le signe de psoas (douleur à la flexion de la cuisse) démontre la présence d’un foyer irritant à proximité du muscle. Lors du toucher rectal ou vaginal, la palpation de la région droite du cul de sac de Douglas est douloureuse.
|
MANIFESTATIONS CLINIQUES
DE L’APPENDICITE AIGUE (d’après DE
DOMBAL) |
|
INTERROGATOIRE · Douleur - Epigastrique >>> F.I.D. - Continue - Précise - Augmentée à la toux et aux mouvements · Anorexie + Nausées + Vomissements EXAMEN PHYSIQUE · Syndrome inflammatoire modéré · Douleur à la palpation de la F.I.D. : précise · Contracture, Défense, Péritonisme · T.R. : douleur à droite. |
c. Examens complémentaires
Les examens complémentaires (biologiques ou radiologiques) ont pour objet essentiel d’aider au diagnostic différentiel. La leucocytose est non fiable et remplacée par le dosage de la C-réactive protéine. Un cliché d’abdomen sans préparation sera réalisé en routine tout au moins en milieu hospitalier. La présence d’une anse grêle dilatée dans la fosse iliaque droite plaide en faveur du diagnostic d’appendicite aiguë, mais ce signe est inconstant. Le principal intérêt de l’abdomen sans préparation est le diagnostic différentiel avec des affections comme l’occlusion intestinale.
L’échographie est utilisée en routine dans les services hospitaliers. Sa spécificité est de près de 100% mais sa sensibilité n’excède pas 75%. Un examen négatif ne permet pas d’éliminer le diagnostic avec une fiabilité suffisante. La tomodensitométrie a une sensibilité et une spécificité d’environ 80%, et son utilisation en routine n’est pas acceptée par de nombreux chirurgiens. Ses principales indications sont l’évaluation des malades présentant des douleurs de la FID peu évocatrices d’appendicite aiguë et les patients chez lesquels on suspecte la présence d’un abcès appendiculaire. Il ne convient pas que la réalisation de ces examens retarde inutilement le traitement.
Le développement récent de la chirurgie coelioscopique a introduit un élément nouveau dans le diagnostic de l’appendicite aiguë. La coelioscopie permet un diagnostic quasi certain. Jadis, réservée aux diagnostics différentiels difficiles entre appendicite aiguë et affection gynécologique, elle tend à devenir généralisée, car la coelioscopie permet non seulement le diagnostic, mais également le traitement sans laparotomie.
Le bénéfice de la coelioscopie n'est pas encore démontré et reste controversé.
2. Autres formes cliniques
a. L’abcès appendiculaire
L’abcès appendiculaire est formé par l’agglutination du caecum, des dernières anses grêle et de l’épiplon. Non traité, il peut se fistuliser vers un organe voisin comme la vessie. Il se manifeste par la présence, dans la fosse iliaque droite, d’une masse douloureuse, mal délimitée, fixée sur le plan profond. Le cul-de-sac de Douglas est parfois tombé et électivement douloureux. L’échographie et plus encore la tomodensitométrie sont les plus utiles pour confirmer le diagnostic.
b. La péritonite appendiculaire
La perforation en péritoine libre provoquant une péritonite généralisée, se manifeste souvent tout d’abord par la diminution ou même la disparition de la douleur (accalmie traîtresse de Dieulafoy). Après quelques heures, la douleur réapparaît mais elle est, cette fois, généralisée à tout l’abdomen et s’accompagne de tous les signes de péritonite.
c. L’appendicite rétro-caecale
La douleur et la défense de la fosse iliaque droite manquent souvent. Il faut chercher les symptômes au-dessus de la crête iliaque droite. L’irritation de l’uretère voisin peut provoquer des symptômes identiques à ceux des affections urétérales.
d. L’appendicite pelvienne
La douleur, dans ce cas, prend l’aspect d’une douleur ovarienne ou vésicale.
e. L’appendicite du vieillard
Les symptômes sont souvent très atténués : peu de douleurs, pas ou peu de défense, signes inflammatoires cliniques et biologiques discrets ou absents. Souvent le diagnostic est fait tardivement ou au stade des complications.
D. TRAITEMENT
1. L’appendicite non compliquée
L’appendicectomie simple est indiquée. Elle sera pratiquée sans délai. Des antibiotiques seront administrés immédiatement avant le début de l’intervention. Ce traitement sera poursuivi durant 48 heures. Son but est de prévenir l’infection de la plaie opératoire.
2. L’abcès appendiculaire
L’abcès appendiculaire sera opéré après une préparation ne dépassant pas quelques heures (mise en place d’une sonde gastrique, perfusions veineuses corrigeant l’hypovolémie et les troubles électrolytiques, antibiothérapie). L’abcès sera débridé, puis vidé et l’appendice sera réséqué. Un drainage de l’abcès sera réalisé. L’antibiothérapie sera poursuivie durant 7 à 8 jours.
3. La péritonite appendiculaire
La préparation préopératoire est la même que pour l’abcès appendiculaire. Après résection de l’appendice, le péritoine sera abondamment lavé et drainé. Une antibiothérapie sera poursuivie durant 7 à 8 jours.
|
DIAGNOSTIC DIFFERENTIEL DE L’APPENDICITE AIGUE CHEZ L’ADULTE |
|
Douleur
abdominale non spécifique AFFECTIONS DIGESTIVES 1.
Entérites aiguës
(virales, microbiennes, parasitaires) 2.
Maladie de Crohn 3.
Ulcère pylorique
perforé 4.
Adénite
mésentérique Cholécystite aiguë Occlusions intestinales débutantes Cancer du caecum Diverticulite de Meckel Invagination intestinale Tuberculose et amibiase caecale Péritonite primitive AFFECTIONS GYNECOLOGIQUES Rupture folliculaire Pelvi-péritonites Grossesse tubaire Kystes de l’ovaire (tordus ou hémorragiques) AFFECTIONS UROLOGIQUES Colique néphrétique Pyélite AFFECTIONS EXTRA-DIGESTIVES Zona Pneumonies de la base droite Porphyries – Saturnisme Purpura rhumatoïde |
II. L’APPENDICITE CHRONIQUE
Les manifestations cliniques de l’appendicite chronique se limitent à des douleurs continues ou intermittentes de la F.I.D. éventuellement accompagnées de nausées et d’anorexie. Aucun examen biologique ou radiologique ne permet de confirmer le diagnostic. Quelques rares malades sont améliorés de manière spectaculaire pour une appendicectomie.
Il ne faut accepter le diagnostic d’appendicite chronique qu’après s’être assuré que les douleurs sont réellement chroniques (plusieurs mois) et qu’il n’existe aucune autre pathologie expliquant ces douleurs. La coelioscopie est un examen utile pour le diagnostic des douleurs chroniques de la fosse iliaque droite.
Une appendicectomie peut être envisagée si un examen clinique minutieux et des investigations complémentaires ont exclu toute autre lésion organique.
III. LES TUMEURS APPENDICULAIRES
Les tumeurs de l’appendicite sont très rares et sont habituellement diagnostiquées lors d’une opération pratiquée avec le diagnostic d’appendicite aiguë ou chronique. Il est indispensable d’examiner histologiquement les appendices réséqués afin de diagnostiquer les petites tumeurs appendiculaires.
Deux formes particulières méritent d’être signalées :
Le carcinoïde de l’appendice est la tumeur carcinoïde la plus fréquente. Il a une évolution, en général bénigne, les métastases étant rares. Lorsqu’une tumeur carcinoïde est découverte sur une pièce d’appendicectomie, aucun traitement complémentaire n’est indiqué pour les tumeurs de moins de 6 mm de diamètre sauf s’il existe un envahissement de la tranche de section ou des ganglions satellites. Dans ce dernier cas, une hémicolectomie droite sera pratiquée.
Le mucocèle appendiculaire est une dilatation kystique de l’appendice contenant du mucus. Il est dû à une hyperplasie simple, locale, mucosécrétante de la muqueuse (polype hyperplasique) ou à un état néoplasique (cystadénome ou rarement cystadénocarcinome). Lorsque le mucocèle est d’origine néoplasique, il peut se compliquer, en cas de rupture, de pseudomyxome péritonéal. Les cellules libérées au moment de la rupture s’implantent dans le péritoine et remplissent celui-ci d’un liquide gélatineux.
En cas de mucocèle, l’appendicectomie s’impose, mais il faut éviter de rompre l’appendice distendu afin de ne pas provoquer de pseudomyxome péritonéal.

 Elle est surtout
réservée au stade II. Un petit anneau élastique, placé à la base de
l’hémorroïde, entraîne, par constriction, la nécrose lente de celle-ci. Ce
traitement peut être réalisé ambulatoirement (fig. 14).
Elle est surtout
réservée au stade II. Un petit anneau élastique, placé à la base de
l’hémorroïde, entraîne, par constriction, la nécrose lente de celle-ci. Ce
traitement peut être réalisé ambulatoirement (fig. 14).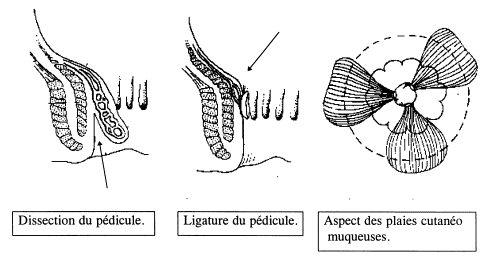
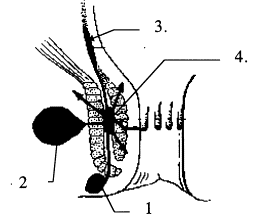 2. l’abcès ischio-rectal (dans la fosse
ischio-rectale)
2. l’abcès ischio-rectal (dans la fosse
ischio-rectale)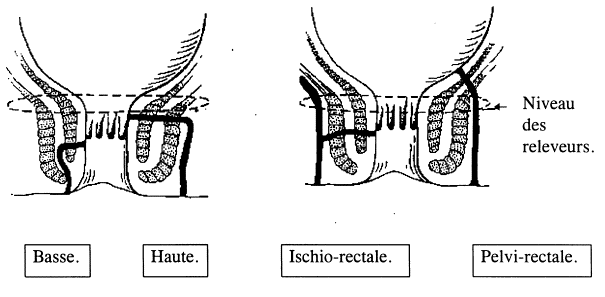
 Les fistules basses (60-70% des cas) qui ne
s’étendent pas au-dessus du niveau de la ligne pectinée. Traversant le seul
sphincter interne, elles sont appelées intersphinctériennes. Lorsqu’elles
traversent les deux sphincters, elles sont dites sphinctériennes.
Les fistules basses (60-70% des cas) qui ne
s’étendent pas au-dessus du niveau de la ligne pectinée. Traversant le seul
sphincter interne, elles sont appelées intersphinctériennes. Lorsqu’elles
traversent les deux sphincters, elles sont dites sphinctériennes.
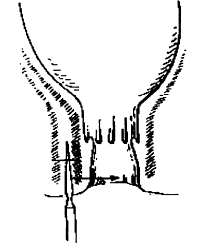 Les patients
résistant à ces traitements ou porteurs d’une fissure anale chronique sont
justiciables d’une section chirurgicale
partielle du sphincter interne qui réduit le spasme anal. La dilatation
anale forcée sous narcose est généralement abandonnée (fig. 20).
Les patients
résistant à ces traitements ou porteurs d’une fissure anale chronique sont
justiciables d’une section chirurgicale
partielle du sphincter interne qui réduit le spasme anal. La dilatation
anale forcée sous narcose est généralement abandonnée (fig. 20).